Enzimologia: El grup de recerca de Dorothea Fiedler sobre biologia química de la transducció de senyals treballa especialment en el rol que el fosfat té en les cascades de senyalització proteica i en les xarxes metabòliques. Al capdavall, la fosforilació de proteïnes és un mecanisme de senyalització central en la cèl·lula eucariòtica. La fosforilació constitueix un dels tipus més habituals de modificació post-traduccional de proteïnes. Habitualment, es tracta d’una monofosforilació, però també hi ha casos de pirofosforilació i de polifosforilació. El laboratori de Fiedler ha trobat un altre cas, l’autooligofosforilació, tal com expliquen en un article a Nature Chemistry amb el doctorand Arif Çelik com a primer autor. Çelik et al. han estudiat els efectes en l’activitat enzimàtica de la nucleòsid-difosfat-cinasa A (NME1) que produeixen la fosforilació i pirofosforilació específica de lloc. Trobaren que la fosforilació en el residu de treonina-94 (Thr94, S94) redueix l’activitat enzimàtica. Encara més ho fa la pirofosforilació, que consisteix en l’addició d’una cadena de dos grups fosfat (difosfat o pirofosfat). La fosfoproteïna i la pirofosfoproteïna resultants, però, són capaces de catalitzar la seva pròpia oligofosforilació, emprant ATP com a cofactor, i arribat a la formació d’una cadena de sis grups fosfats (hexafosfat). Aquesta oligofosforilació depèn de manera crítica del residu catalític histidina-118 (His-118). L’anàlisi de microscòpia electrònica criogènica fa pensar en un mecanisme de transferència intramolecular del grup fosforil. L’oligofosforilació de NME1 en mostres bioquímiques i en lisats cel·lulars ha estat confirmada per espectrometria de masses. Entre els efectes de l’oligofosforilació hi ha la promoció de tota una sèrie d’interaccions de proteïnes.
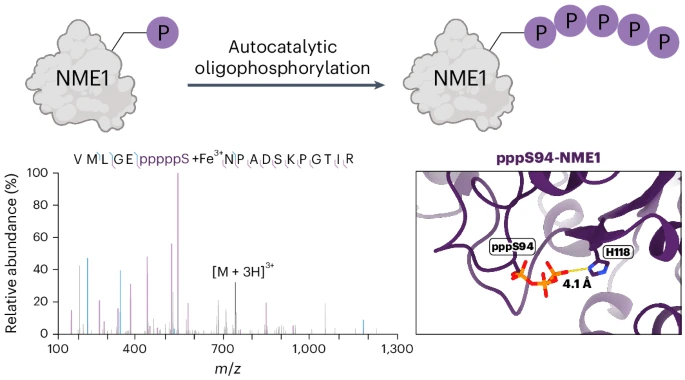
Çelik et al. mostren que la proteïna NME1 és capaç de realitzar una oligofosforilació autocatalítica en el residu S94
La fosforilació de proteïnes
La fosforilació de proteïnes té un paper central en la senyalització cel·lular participant en la regulació d’un ample ventall de processos biològics. En general, consisteix en l’addició d’un grup fosfat a residus de serina o treonina (reacció catalitzada per les serin-treonin-cinases) o a residus de tirosina (reacció catalitzada per les tirosin-cinases). Les anàlisis fosfoproteòmiques de dalt-a-baix han permès l’anotació de milers de llocs o residus de fosforilació en un sol experiment. Hom ha desenvolupat també anticossos pan-específics capaços de detectar fosfotirosines (pY), fosfoserines (pS) i fosfotreonines (pT) en seqüències específiques. El Banc de Dades de Proteïnes (PDB) conté moltes estructures de proteïnes fosforilades.
Més enllà d’aquesta ‘monofosforilació canònica de serines, treonines i tirosines’, el fosfoproteoma de mamífers conté altres tipus de fosforilació. Hi ha fosforilacions d’histidines, arginines, cisteïnes, aspartats, glutamats i lisines. Hom ha desenvolupat anticossos per a la detecció de fosfohistidines (pHis) i de fosfoarginines (pR).
Un altre exemple de fosforilació no-canònica és la pirofosforilació, que consisteix en l’addició d’un altre grup fosfat sobre pS o pT. Això es fa a través de missatgers d’inositol-pirofosfat, i en resulta un residu pirofosforilat (o difosforilat).
També existeix la polifosforilació. Això consisteix en l’addició de cadenes de polifosfat inorgànic (poliP) a proteïnes que contenen dominis PASK (caracteritzats per la riquesa de residus poliacídics, de serina i de lisina).
Hom ha utilitzat l’espectrometria de masses per identificar vora 150 llocs de pirofosforilació. Alguns d’aquests llocs es troben en seqüències consens dirigides per prolines. És el cas d’algunes protein-cinases, com ara la nucleòsid-difosfat-cinasa A (NME1).
La NME1 és un enzim multifuncional. Hom ha observat que es troba pirofosforilat en el residu Thr94 en cèl·lules humanes. La NME1 participa en la síntesi de nucleòsid-trifosfats diferents de l’ATP. Ho fa catalitzant la transferència del grup γ-fosforil de l’ATP cap a un nucleòsid-difosfat (NDP), a través d’un intermediari de fosfohistidina en el seu centre actiu.
NME1, a més, és una serin/treonin-cinasa, i fosforila proteïnes com la KSR1. Hom postula que també és una histidin-cinasa, i s’ha observat aquesta activitat in vitro sobre l’ATP-citrat-liasa o sobre la succinat-tiocinasa.
Hom ha caracteritzat la NME1 com un supressor de metàstasi en melanomes i càncers de mama. Ara bé, la fosforilació de NME1 en les posicions Ser120, Ser122 i Ser125, han estat vinculades a la progressió tumoral. La posició més sovint fosforilada de NME1 és Thr94, situada a prop del lloc d’unió a ATP.
Çelik et al. han aconseguit la síntesi i caracterització de la NME1 estequiomètricament fosforilada i pirofosforilada en Thr94. La fosforilació redueix l’activitat NDP-cinasa, i la pirofosforilació la suprimeix completament.
En el marc de l’anàlisi per espectrometria de masses i microscòpia electrònica criogènica, Çelik et al. trobaren inesperadament la formació autocatalítica ATP-dependent d’una cadena d’oligofosfat en Thr94. Aquesta autocatàlisi tenia lloc in vitro amb l’únic requeriment inicial de l’addició d’un grup monofosfat per part de la CDK1.
Çelik et al. estiraren del fil i trobaren que la NME1 oligofosforilada és present és lisats cel·lulars. També comprovaren que l’oligofosforilació té conseqüències en la capacitat d’interacció de la NME1 amb altres proteïnes.
La generació de NME1 fosforilada i pirofosforilada
Çelik et al. començaren l’estudi amb la intenció d’aconseguir proteïna NME1 fosforilada i pirofosforilada a Thr94 d’una manera específica de posició i amb una estequiometria coneguda. Per fer-ho aplicaren un mètode que combina la supressió del codó ambre de terminació de cadena proteica amb una reacció quimioselectiva basada en un reactiu fotolàbil P-imidazòlid.
D’entrada es focalitzaren en l’expressió de pT94-NME1 en el bacteri Escherichia coli. Assoliren la fosfoproteïna pT94-NME1 amb alta puresa, però amb un rendiment baix (0,05 mg/L, quan podien assolir la NME1 sense fosforilar a 33 mg/L). Optaren per fer la substitució T94S, amb l’esperança que la pS94-NME1 funcionaria millor. El rendiment pujà a 0,75 mg/L.
La pS94-NME1 té un massa molecular de 18168 Da. Aplicant la tècnica de derivatització obtingueren R-ppS94-NME1, cosa que verificaren amb una espectrometria de masses (Q-TOF-MS). La ppS94-NME1 té una massa molecular de 18248 Da.
La pirofosforilació de redueix l’activitat NDP-cinasa de NME1
Amb un assaig estàndard de cinasa amb els substrats GDP i TDP, acoblada a monitorització de consum d’ATP, comprovaren que la pirofosforilació redueix aquesta activitat enzimàtica. La pT94-NME1 té una activitat 100 vegades inferior a la NME1. La pS94-NME1 té una activitat igualment reduïda. La ppS94-NME1 no té pràcticament activitat NDP-cinasa.
Com que Thr94 es troba adjacent al lloc d’unió de nucleòtids, Çelik et al. pensaven que la fosforilació i la pirofosforilació dificulta l’accés de l’NDP. Així podria haver una correlació amb la fosforilació de la His118, que participa en l’activitat NDP-cinasa. L’ús d’un anticòs pan-específic de pHis mostrava que aquest no era el cas, i que la pS94-NME1 té uns nivells de pHis118 semblants a la NME1 originària.
Quan la ppS94-NME1 era incubada amb ATP es generava l’addició de quatre o cinc grups fosforils, manifestats en augments de la massa molecular de 360 i de 400 Da. La ppS94-NME1(H118F) no experimentava aquesta hiperfosforilació.
L’auto-oligofosforilació de NME1
Çelik et al. decidiren aprofundir en aquesta hiperfosforilació de ppS94-NME1. La digestió amb tripsina i anàlisi per MS/MS no mostrava cap lloc addicional de fosforilació.
L’anàlisi per espectrometria de masses indicava desplaçaments de 184 Da i 213 Da, atribuïbles a grups fosfats i a ions d’Al3+ i de Fe3+. En Ser94 trobaven entre 3 i 5 grups fosforils. Amb una optimització de la tècnica de MS trobaren finalment pèptids amb fins a 6 grups fosforils, sempre quelant ions d’Al3+ i de Fe3+.
Aquesta oligofosforilació també era observada sense tractament amb ATP. En pS94-NME1 directament obtinguda d’E. coli també s’observaven la formació de cadenes d’oligofosfat en la Ser94. Aquestes cadenes eren absents en pS94-NME1(H118F). Això suggeria una transferència autocatalític de fosforil entre His118 i Ser94. Pel que fa a la pT94-NME1 també es detectava piro- i oligofosforilació en la Thr94.
L’oligofosforilació de NME1 en cèl·lules HEK293T
Çelik et al. lisaren i digeriren la línia cel·lular humana HEK293T. Els homogenats eren tractats amb λ-fosfatasa. Hi trobaren pèptids NME1 pirofosforilats, trifosforilats i tetrafosforilats. Aquesta oligofosforilació es feia a Thr94. La piro- i tri-fosforilació suposa quantitativament un 8-15% de la monofosforilació.
La fosforilació per CDK1 redueix l’activitat NDP-cinasa
La incubació de NME1 amb CDK1 en presència d’ATP i de MgCl2 condueix a la fosforilació de la Thr94 de NME1. Això resulta en una disminució de l’activitat NDP-cinasa de NME1.
L’estructura de la ppS94-NME1
La crio-EM i l’anàlisi de partícula única (SPA) permeten Çelik et al. de visualitzar les alteracions estructurals de NME1 arran de la fosforilació i de la pirofosforilació. El grup fosforil de pS94-NME1 s’orienta cap a la cadena lateral d’His118. Això encara és més marcat en ppS94-NME1, amb la formació d’un possible pont d’hidrogen entre l’N1 d’His118 i el grup fosfat terminal de ppS94. La proximitat és encara major amb la pppS94-NME1.
Moltes proteïnes interactuen preferentment amb l’oligo-pS94-NME1
Çelik et al. incubaren lisats de HEK293T amb NME1 o amb pS94-NME1. Aquesta tècnica permet la detecció de proteïnes que interactuen amb NME1. En total detectaren 200 proteïnes interactores amb NME1, de les quals identificaren 70. La immensa majoria d’aquestes interaccions no eren afectades per la monofosforilació en S94.
La cosa era diferent amb oligo-pS94-NME1. Molts interactors, certament, mantenen les mateixes preferències, però hi ha 80 proteïnes que mostren una associació preferencial amb oligo-pS94-NME1. Entre aquestes proteïnes trobem representades les que participen en l’espliceosoma (CDC5L, PRPF40A, DDX41, CWC27, CWC22, SRRM1, SRPK1, SART1, PNN, PRPF6, TRA2B, SNIP1, RNPS1, PPIL3). També hi trobem la DYRK1A, l’exopolifosfatasa PRUNE1 i la pirofosfatasa 1 (PPA1). És intrigant que ni la PRUNE1 ni la PPA1 tinguin una activitat defosforilada per a oligo-pS94-NME1.
Sigui com sigui, Çelik et al. ens han introduït a l’oligofosforilació com a mecanisme de modificació post-traduccional de proteïnes.
Lligams:
- Nucleoside diphosphate kinase A (NME1) catalyses its own oligophosphorylation. Arif Celik, Felix Schöpf, Christian E. Stieger, Sarah Lampe, Björn Hanf, Jeremy A. M. Morgan, Max Ruwolt, Fan Liu, Christian P. R. Hackenberger, Daniel Roderer & Dorothea Fiedler. Nature Chemistry (2025).
Cap comentari:
Publica un comentari a l'entrada