Exòmica: L’heretabilitat de la malaltia d’Alzheimer és d’un 70%. Mitjançant estudis d’associació de tot el genoma ha estat possible identificar variants genètiques associades amb un major risc de desenvolupar aquesta malaltia. En aquest treball d’identificació poden ser útils els estudis exòmics, que centren l’anàlisi genòmica en la fracció dels gens que apareixen en l’ARN missatger madur (els exons). Henne Holstege és la primera autora d’un article publicat ahir a la revista Nature Genetics que fa una comparació de les dades de seqüenciació exòmica de 32.558 individus, dels quals 16.036 han estat diagnosticats de la malaltia d’Alzheimer i els altres 16.522 fan de controls. Aquest estudi cas-control permeten Holstege et al. d’avaluar l’associació de la malaltia d’Alzheimer amb variants genètiques perjudicials rares. Com era d’esperar han trobat associació per a variants dels gens TREM2, SORL1 i ABCA7, com ja ho havien fet estudis genòmics previs. A més, però, aquest estudi exòmic posa de manifest que hi havia variants associades al risc de malaltia d’Alzheimer per als gens ATP8N4 i ABCA1. Menys clara és l’associació amb variants del gen ADAM10. Addicionalment, Holstege et al. assenyalen altres gens: RIN3, CLU, ZCWPW1 i ACE. Les variants perjudicials que mostren major associació són les que condueixen a una pèrdua de funció del gen afectat. Holstege et al. han trobat que aquestes variants apareixen amb una major freqüència gènica entre les persones que desenvoluparen un malaltia d’Alzheimer a una edat relativament primerenca. No és d’estranyar que els gens implicats participin en el processament de la proteïna precursora del beta-amiloide, en l’agregació de beta-amiloide, el metabolisme lipídic i la funció microglial.
Variants genètiques SORL1, TREM2, ABCA7, ATP8B4 i ABCA1 que condueixen a la pèrdua de funció s’associen a un major risc de desenvolupar la malaltia d’Alzheimer i de fer-ho a edats menys avançades
Els factors genètics de la malaltia d’Alzheimer
L’herència mendeliana explica menys d’un 1% dels casos de malaltia d’Alzheimer que apareixen a edats anteriors als 65 anys. En aquests casos la causa darrera és un al·lel autosòmic dominant. No obstant això, fins i tot en la resta de casos d’Alzheimer, l’heretabilitat és d’un 70%. Els factors genètics darrera d’aquesta heretabilitat són força complexos. Els estudis d’associació de tot el genoma han posat de manifest un total de 75 factors de risc genètics, com ja vam comentar el passat mes d’abril. Cadascun d’aquests factors genètics té una contribució modesta al desenvolupament de la malaltia d’Alzheimer.
Els estudis que incorporen estratègiques de seqüenciació d’ADN han posat de manifest variants rares (amb una freqüència al·lèlica inferior a l’1%) dels gens TREM2, SORL1 i ABCA7 que tenen una contribució més elevada en el desenvolupament de la malaltia d’Alzheimer. Aquestes variants rares condueixen a una pèrdua de funció o a un altre tipus de dany als gens respectius.
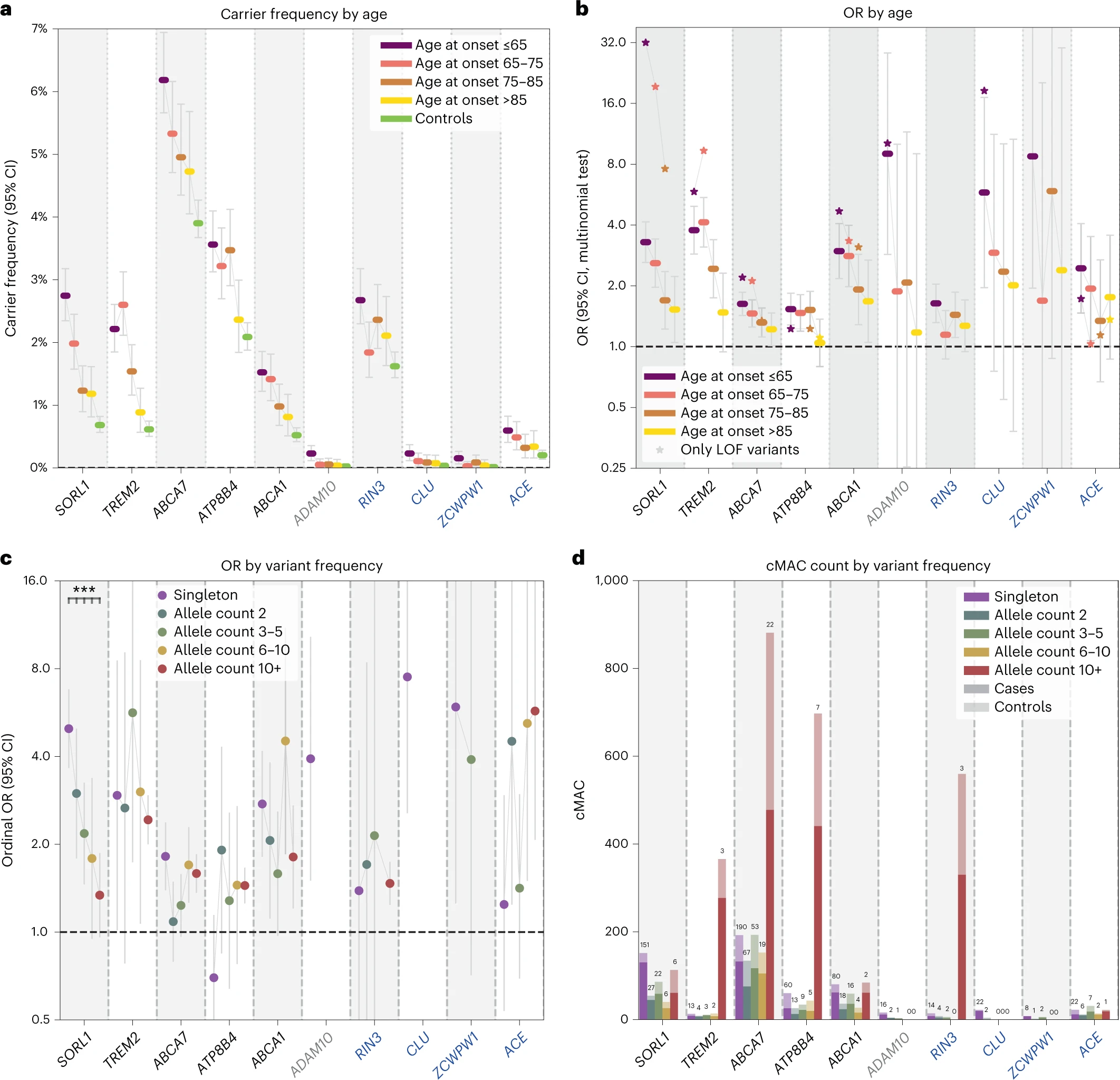
En aquest estudi, en el que han participat especialment Henne Holstege, Marc Hulsman, Gaël Nicholas i Jean-Charles Lambert, es persegueix la detecció de gens addicionals que presentin variants rares deletèries que s’associïn a un major risc de presentar la malaltia d’Alzheimer. Per fer-ho han de recórrer a la comparació de dades de seqüenciació genètica de milers de persones, tant de malalts d’Alzheimer com de controls. Així, Holstege et al. han harmonitzat dades de seqüenciació d’estudis realitzats a Europa i als Estats Units sobre els que han aplicat una anàlisi de càrrega de gens. El fet que les seqüenciacions es realitzessin en centres diferents comporta tota una sèrie de biaixos tècnics que han d’afrontar a través de procediments de control de qualitat.
Seguidament es comparava la càrrega de variants rares que presentaven 12.652 casos de malaltia d’Alzheimer (incloent-hi 4.060 que havien desenvolupat la malaltia abans de 65 anys) i 8.693 controls. D’aquesta comparació resulta la detecció de 7.543.193 variants. D’aquests variants se seleccionaren les que tenien freqüències al·lèliques inferiors a l’1% i que, d’acord amb una anàlisi bioinformàtica, indicaven una afectació en el producte gènic respectiu. Les variants foren classificades segons el nivell predit de perjudici.
En els cromosomes autosòmics (=no sexuals) del genoma humà hi ha 19.822 gens codificadors de proteïnes. D’aquests, Holstege et al analitzaren els 13.222 que tenien un recompte acumulat d’al·lels menors igual o superior de 10. Sobre aquests gens es realitzaren 31.204 tests de càrrega. D’aquests tests n’hi hagué 13, corresponents a 6 gens, que indicaven una càrrega diferencial de variants rares entre casos i controls. Els gens en qüestió són SORL1, TREM2, ABCA7, ATP8B4, ADAM10 i ABCA1.
Aquests senyals foren validats en una fase posterior que contemplava 3.384 casos d’Alzheimer i 7.829 controls. L’associació fou confirmada per a variants perjudicials rares dels gens SORL1, TREM2, ABCA7, ATP8B4 i ABCA1.
En una tercera fase, Holstege et al. consideraren els 75 gens que apareixen associats al risc de malaltia d’Alzheimer en estudis d’associació de tot el genoma. D’aquests 75 gens, n’hi ha 67 que presenten variants rares que es troben amb major freqüència entre els casos d’Alzheimer. A més dels gens ja esmentats, són particularment forts els senyals corresponents als gens RIN3, CLU, ZCWPW1 i ACE.
Aquests gens participen en funcions biològiques com el processament de la proteïna precursora del beta-amiloide (APP), en el metabolisme lipídic, en l’agregació de beta-amiloide (Aβ) i en processos neuroinflamatoris. Tots aquests són aspectes ben coneguts de la fisiopatologia de la malaltia d’Alzheimer. Els productes gènics de ABCA7 i ATP8B4 són transportadors de fosfolípids. Variants rares del gen ATP8B4 ja s’havien descrit com a associades a un major risc de desenvolupar esclerosi sistèmica. En el cervell, el gen ATP8B4 és predominantment expressat en la microglia (les cèl·lules no-neuronals del sistema nerviós). La mutació G395S del gen ATP8B4 és la que més repetidament apareix en els casos de malaltia d’Alzheimer estudiats per Holstege et al.
També és il·lustratiu el fet que el transportador de fosfolípids codificat pel gen ABCA1 sigui responsable de la lipidació de l’apolipoproteïna E (el gen de la qual ja fou descrit com a associat a la malaltia d’Alzheimer en estudis de genètica molecular clàssica). Una insuficient lipidació de les lipoproteïnes que contenen APOE augmenta la deposició de Aβ i la fibril·logènesi. Això és el que passa, per exemple, amb la mutació N1800H del gen ABCA1.
Lligams:
- Exome sequencing identifies rare damaging variants in ATP8B4 and ABCA1 as risk factors for Alzheimer’s disease. Henne Holstege, Marc Hulsman, Camille Charbonnier, Benjamin Grenier-Boley, Olivier Quenez, Detelina Grozeva, Jeroen G. J. van Rooij, Rebecca Sims, Shahzad Ahmad, Najaf Amin, Penny J. Norsworthy, Oriol Dols-Icardo, Holger Hummerich, Amit Kawalia, Philippe Amouyel, Gary W. Beecham, Claudine Berr, Joshua C. Bis, Anne Boland, Paola Bossù, Femke Bouwman, Jose Bras, Dominique Campion, J. Nicholas Cochran, Antonio Daniele, Jean-François Dartigues, Stéphanie Debette, Jean-François Deleuze, Nicola Denning, Anita L. DeStefano, Lindsay A. Farrer, Maria Victoria Fernández, Nick C. Fox, Daniela Galimberti, Emmanuelle Genin, Johan J. P. Gille, Yann Le Guen, Rita Guerreiro, Jonathan L. Haines, Clive Holmes, M. Arfan Ikram, M. Kamran Ikram, Iris E. Jansen, Robert Kraaij, Marc Lathrop, Afina W. Lemstra, Alberto Lleó, Lauren Luckcuck, Marcel M. A. M. Mannens, Rachel Marshall, Eden R. Martin, Carlo Masullo, Richard Mayeux, Patrizia Mecocci, Alun Meggy, Merel O. Mol, Kevin Morgan, Richard M. Myers, Benedetta Nacmias, Adam C. Naj, Valerio Napolioni, Florence Pasquier, Pau Pastor, Margaret A. Pericak-Vance, Rachel Raybould, Richard Redon, Marcel J. T. Reinders, Anne-Claire Richard, Steffi G. Riedel-Heller, Fernando Rivadeneira, Stéphane Rousseau, Natalie S. Ryan, Salha Saad, Pascual Sanchez-Juan, Gerard D. Schellenberg, Philip Scheltens, Jonathan M. Schott, Davide Seripa, Sudha Seshadri, Daoud Sie, Erik A. Sistermans, Sandro Sorbi, Resie van Spaendonk, Gianfranco Spalletta, Niccolo’ Tesi, Betty Tijms, André G. Uitterlinden, Sven J. van der Lee, Pieter Jelle Visser, Michael Wagner, David Wallon, Li-San Wang, Aline Zarea, Jordi Clarimon, John C. van Swieten, Michael D. Greicius, Jennifer S. Yokoyama, Carlos Cruchaga, John Hardy, Alfredo Ramirez, Simon Mead, Wiesje M. van der Flier, Cornelia M. van Duijn, Julie Williams, Gaël Nicolas, Céline Bellenguez & Jean-Charles Lambert. Nature Genetics (2022).
- Un càlcul del risc genètic de patir la malaltia d’Alzheimer d’acord amb 75 loci (abril del 2022).
Cap comentari:
Publica un comentari a l'entrada