Fa temps que sabem que la visió d’un sistema nerviós integrat per unes neurones que fan i desfan, i una glia que els presta suport és incompleta. En realitat comunicacions multimodals entre cèl·lules glials com els astròcits i les neurones controlen l’estructura i la funció del sistema nerviós central. Els grups de recerca de Ludovic Telley i d’Andrea Volterra, des de Losena, estudien aquesta interacció entre astròcits i neurones. Saben que els astròcits són capaços d’alliberar ràpidament quantitats de glutamat prou elevades com per controlar l’excitabilitat, plasticitat i activitat sincrònica de xarxes de neurones interconnectades per sinapsis. Aquest mecanisme sembla també al darrera de problemes neurològics i psiquiàtrics. Però si els astròcits poden fer això és perquè compten d’un aparell d’exocitosi similar a les neurones, possiblement dependent de calci. En un article publicat a la revista Nature que té a Roberta de Ceglia com a primera autora es presenten dades a favor d’aquesta hipòtesi de l’exocitosi de glutamat per astròcits. A través d’eines moleculars, bioinformàtiques i d’imatge capaces d’explorar l’heterogeneïtat funcional dels astròcits, i d’interferir en el procés d’exocitosi de glutamat in vivo, De Ceglia et al. han identificat nou clústers diferents d’astròcits hipocampals entre els quals hi ha una subpoblació que expressa components de la maquinària d’alliberament de glutamat pròpia de les sinapsis neuronals. Aquesta població d’astròcits es localitza en punts concrets de l’hipocamp. Amb un marcador de glutamat pel sistema GluSn-FR, De Ceglia constaten que aquest subgrup d’astròcits pot desencadenar l’alliberament local de glutamat quan rep l’estimulació adequada. Aquest alliberament queda suprimit si s’indueix en astròcits la deleció del transportador de glutamat VGLUT1. Aquests astròcits glutamatèrgics participen en la funció normal i patològica dels circuits cortico-hipocampals i nigrostriatals. Així doncs, podrien constituir una diana terapèutica en algunes neuropaties.
De Ceglia et al. han identificat una subpoblació d’astròcits glutamatèrgics en l’hipocamp murí i humà
L’anàlisi transcriptòmica de cèl·lules individuals
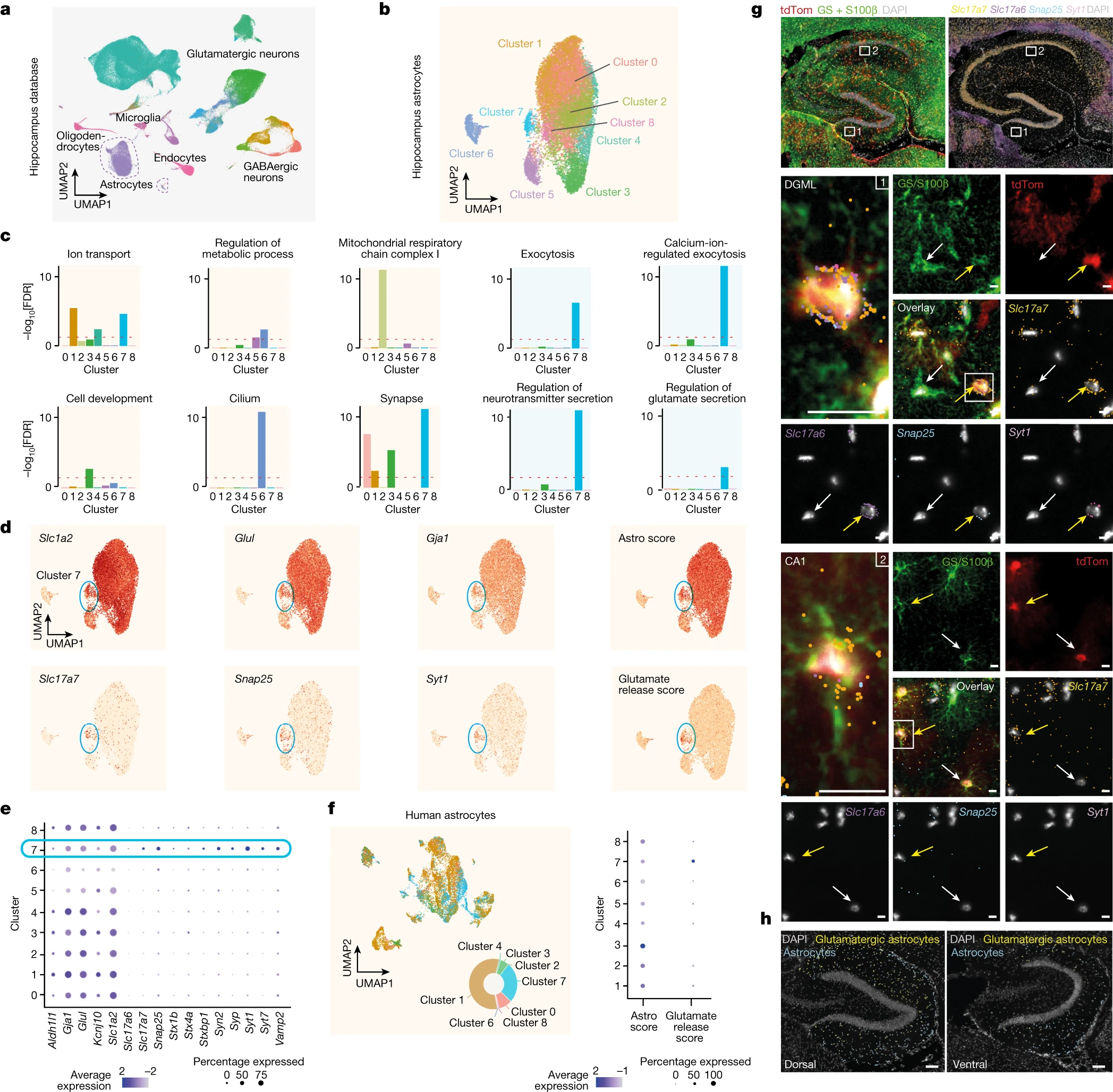
De Ceglia et al. han recorregut a l’anàlisi transcriptòmica de cèl·lules individuals amb l’objectiu d’identificar astròcits capaços d’alliberar glutamat a través d’una maquinària vesicular d’exocitosi. El primer pa fou integrar vuit bases de dades de cervell de ratolí que recullen dades de seqüenciació d’ARN de cèl·lules isolades (scRNA-seq) o de nuclis isolats (snRNA-seq) que cobreixen cèl·lules hipocampals i, particularment, astròcits. En avaluar les dades de cèl·lules hipocampals hi troben 15 clústers transcripcionals, corresponents als principals tipus cel·lulars clàssics. Així doncs hi trobaven neurones glutamatèrgiques, neurones GABAèrgiques, cèl·lules no-neuronals, etc. Entre aquestes cèl·lules no-neuronals hi havia astròcits, caracteritzats per l’expressió de gens com Slc1a2 (que codifica la proteïna GLT1), Slc1a3 (que codifica la proteïna GLAST), Gja1 (que codifica la proteïna CX43) i Aqp4.
Astròcits possiblement glutamatèrgics
Diem que una cèl·lula és glutamatèrgica si és capaç d’alliberar en breu temps quantitats prou efectives de glutamat com per excitar una neurona glutamatosensible. El glutamat és un aminoàcid que en el sistema nerviós central actua com a neurotransmissor en sinapsis interneuronals de tipus excitatori.
Entre els astròcits hipocampals de ratolí, De Ceglia et al. identificaren nou clústers. Aquests clústers presenten expressions diferencials de gens implicats en el transport iònic, en processos metabòlics, en la funció mitocondrial, el desenvolupament cel·lular, etc. El clúster 6 es caracteritza per un perfil transcriptòmic que recorda al dels precursors neurals del gir dentat hipocampal. El clúster 7 expressa particularment gens vinculats a l’exocitosi regulada per canals iònics i a la secreció de glutamat.
Dades morfològiques, immunohistoquímiques i transcripcionals indiquen que aquest clúster 7 representa una subpoblació d’astròcits que expressa gens requerits per a la secreció regulada glutamatèrgica.
La distribució d’astròcits glutamatèrgics
En talls histològics d’hipocamp de ratolí, De Ceglia et al. exploren l’alliberament de glutamat vinculat a astròcits. L’estimulació d’astròcits no condueix sempre a l’alliberament de glutamat, sinó únicament en un subgrup d’astròcits. Aquest alliberament astrocític de glutamat resta aturat si s’indueix una afectació en VGLUT1.
En un model de ratolí al que s’ha implantat una cànula optofluida en el gir dentat de l’hipocamp, De Ceglia identifiquen un alliberament de glutamat arran de l’estimulació específica d’astròcits.
El paper dels astròcits glutamatèrgics en la funció hipocampal
De Ceglia et al. treballen amb un model de ratolí transgènic que en resposta al tamoxifè deixa d’expressar el gen Slc17a7 en astròcits. En aquests animals es produeixen canvis en la potenciació a llarg termini, en capacitats de memòria i en patrons d’excitabilitat aguda.
La deleció de VGLUT2 en astròcits altera la funció del circuit nigrostriatal en ratolins.
Els astròcits glutamatèrgics com a diana terapèutica
De Ceglia et al. exposen un exemple de gliotransmissió glutamatèrgica rellevant en la funció hipocampal. L’exocitosi dependent de calci de vesícules carregades de glutamat no seria, doncs, patrimoni exclusiu de les neurones. Aquesta gliotransmissió glutamatèrgica reforça la potenciació a llarg termini, base de la funcions hipocampals vinculades a la memòria; també contraresta la hiperexcitació. Aquestes accions la fan interessant com a possible diana terapèutica en la malaltia de Parkinson.
Lligams:
- Specialized astrocytes mediate glutamatergic gliotransmission in the CNS. Roberta de Ceglia, Ada Ledonne, David Gregory Litvin, Barbara Lykke Lind, Giovanni Carriero, Emanuele Claudio Latagliata, Erika Bindocci, Maria Amalia Di Castro, Iaroslav Savtchouk, Ilaria Vitali, Anurag Ranjak, Mauro Congiu, Tara Canonica, William Wisden, Kenneth Harris, Manuel Mameli, Nicola Mercuri, Ludovic Telley & Andrea Volterra. Nature (2023).
Cap comentari:
Publica un comentari a l'entrada