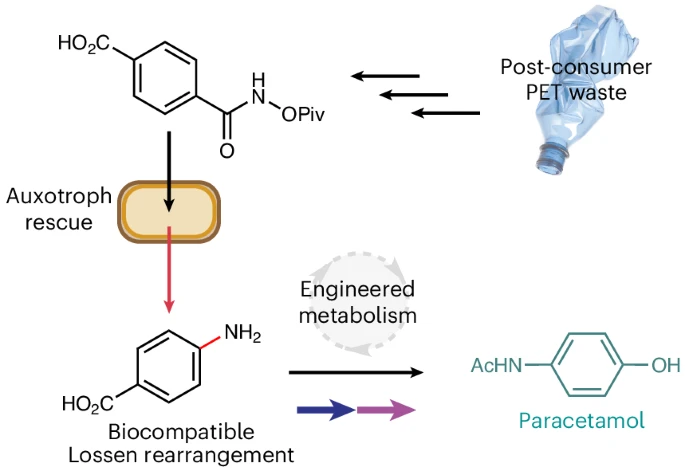
Química orgànica: Stephen Wallace és professor de biotecnologia química de The University of Edinburgh. El seu grup de recerca de química orgànica sintètica treballa en el desenvolupament de reaccions desconegudes en la natura i en integrar aquestes reaccions abiòtiques en sistemes biològics amb vistes a aplicacions industrials i de gestió de residus. El seu col·lega Nick Johnson treballa en la biodegradabilitat de polímers, i en un article a Nature Chemistry, del qual és primer autor, proposa l’ús d’una reacció biocompatible de Lossen feta possible en Escherichia coli. Aquest reordenament de Lossen és catalitzat per fosfat en el bacteri Escherichia coli possibilitant la transformació d’acil-hidroxamats activats en metabòlits primaris que contenen amines. Johnson et al. mostren que aquesta reacció es pot utilitzar e el control del creixement microbià a través de la síntesi d’àcid para-aminobenzoic. Aquest substrat també es pot sintetitzar a partir de tereftalat de polietilè. Això podria ser la base de reaccions biocatalítiques de sistemes de cèl·lules bacterianes per a la generació de petites molècules d’interès industrial, com és el paracetamol, fent servir com a substrat residus plàstics.
La recerca de Johnson et al. posa la base d’una estratègia general per a la bioremediació i reciclatge de residus plàstics en sistemes biològics nadius o modificats per enginyeria genètica
Les reaccions biocompatibles en l’expansió del repertori sintètic dels sistemes biològics
En la tasca d’expansió del repertori biosintètic pot jugar un paper rellevant el desenvolupament de reaccions biocompatibles, és a dir de transformacions químiques no-enzimàtiques situades en la interfície del metabolisme cel·lular.
La química orgànica moderna permet estratègies sintètiques basades en aquestes reaccions biocompatibles amb aplicacions en el control de la funció cel·lular, en la diversificació del rang de metabòlits possibles i en l’accés biològic a materials recalcitrants. Certament això també es pot aconseguir amb altres mètodes de catàlisi abiòtica en sistemes cel·lulars, com ara l’evolució dirigida, la creació de nous centres actius a través de cofactors artificials o aminoàcids alternatius, el disseny computacional d’enzims, etc. D’una manera o altra, però, el repte consisteix en la integració metabòlica d’aquests processos nous en cèl·lules vives.
L’ampliació de la química metabòlica per a la síntesi microbiana obre noves possibilitats a la bioproducció de petites molècules d’aplicació industrial a partir de substrats més diversos. Aquesta aplicació de l’enginyeria biològica pot conduir a una disminució de la dependència de rutes de síntesi petroquímiques. Hom ha desenvolupat així metal·loenzims artificials que permeten a cèl·lules microbianes la generació de nous substrats i apoenzims. És el cas de l’Escherichia coli modificada per enginyeria genètica per sintetitzar el metal·loenzim intracel·lular Ir-CYP119, capaç de la ciclopropanació de limonè sota suplementació amb etil-dioazoacetat. En aquest cas la importació del cofactor Ir-porfirina és possible per la co-expressió de l’operó hug del sistema de transport del grup hem de Plesiomonas shigelloides, que s’acompanya d’una via biosintètica de limonè heteròloga.
Un altre exemple de ciclopropanació biocompatible és fa en E. coli a través d’un catalitzador no-enzimàtic de Fe-ftalocianina. En Streptomyces albus J1074 s’ha construït una sistema de ciclopropanació basada en la transferència de carbè. En Lactococcus lactis s’ha construït un metabolisme de descarboxilació oxidativa catalitzat per grup heme.
Johnson et al. ens proposen fer un pas més enllà en incorporar als sistemes biològics una reacció no-enzimàtica de reordenació de substrats carboxílics activats. Concretament es refereixen a una reacció descoberta per Wilhelm Lossen en el 1872, que es caracteritza per l’expulsió d’un carboxilat d’un substrat d’hidroxilamina bis-acetilat. Aquesta reordenació de Lossen és catalitzada per calor i/o metall. Tipícament implica un èster de fenil-hidrozamat que, sota condicions bàsiques i a través d’una migració 1,2-aril, forma un isocianat que ràpidament reacciona en condicions aquoses per formar un àcid carbàmic que, després es descarboxila cap al producte d’amina primària.
L’aplicació sintètica de la reordenació de Lossen es fa a partir d’àcids carboxílics, bo i evitant l’ús de reactius d’azida. El producte són amines primàries generades a partir de substrats carboxílics, reacció acompanyada de la contracció d’un carboni. En això darrer difereix de les reaccions catalitzades per amoni-liases i aminotransferases.
No és del tot cert que la reordenació de Lossen sigui completament desconeguda en el món biològic. Hom l’ha observat en sistemes in vitro sota presència de quimiotripsina. També s’ha detectat en la via de l’àcid hidroxàmic de Salmonella typhimurium TA98. Però aquests exemples no tenen a veure amb reaccions de síntesi.
Johnson et al. utilitzen la reordenació biocompatible de Lossen d’acil-hidroxamats en cèl·lules vives d’E. coli. Aquesta reacció es pot dur a terme en condicions ambientals sense un efecte tòxic per a aquest bacteri. La catàlisi no és enzimàtica, sinó que es duu a terme pel fosfat inorgànic del propi bacteri. Johnson et al. ho han aplicat emprant com a substrat PET (tereftalat de polietilè) i, a través d’experiments de rescat auxotròfic, mostren com poden fer que el creixement i metabolisme del bacteri depengui d’una petita molècula derivada del PET d’ampolles de plàstic. Aquesta reacció és conduïda cap a la síntesi de para-hidroxiacetanilid, que és el principi actiu del paracetamol, fàrmac amb propietats analgèsiques i antipirètiques.
El rescat auxotròfic
Johnson et al. dissenyaren un experiment de rescat auxotròfic, on una reordenació de Lossen de para-carboxil O-pivalohidroxamat generaria el metabòlit essencial PABA. El PABA és un metabòlit essencial perquè participa en la síntesi d’àcid fòlic. Un microorganisme que no pugui sintetitzar PABA no pot créixer perquè, sense àcid fòlic, pateix defectes en el metabolisme de nucleòtids i acumula danys en el metabolisme d’ADN. Diem llavors que és un microorganisme auxotròfic, perquè només podria créixer si troba PABA en el medi.
Johnson et al., utilitzen una soca d’E. coli auxotròfica per a PABA. Aquesta soca auxotròfica només pot créixer (cosa que es pot monitoritzar a través de la densitat òptica a 600 nm d’un cultiu líquid) si d’alguna manera es pot procurar PABA. Ara bé, la forma de procurar-se aquest PABA no ha de comportar l’ús de catalitzadors tòxics, els quals inhibirien el seu creixement. És a dir que el rescat auxotròfic ha de realitzar-se per un procés biocompatible.
La síntesi d’O-Piv benzhidroxamat 1 es va fer en dues passes a partir d’àcid 4-formilbenzoic a través de la formació d’un enllaç amida amb O-Piv hidroxilamina seguit de l’oxidació d’aldehid per àcid periòdic i clorocromat de piridini.
Els microorganismes auxotròfics utilitzats són una col·lecció de soques d’Escherichia coli K-12 derivades de Keio per knock-out. Entre elles hi ha E. coli BW25113∆pabB, que és knock-out per a la subunitat catalítica de l’aminodesoxicorismat-sintasa, enzim responsable del penúltim pas de la biosíntesi de PABA.
El triatge de catalitzadors fou poblat amb complexos metàl·lics que promouen reordenacions de Lossen o de Curtius, com ara FeCl2, hemina, ferro-ftalocianina, ferroïna, ZnTPP, Zn(PPIX) o Zn(acac)2. El substrat de Lossen esmentat era afegit a tubs de creixement que contenien un medi M9-glicerol i un dels catalitzadors esmentats, i seguidament s’hi inoculava E. coli BW25113∆pabB. En aquests tubs no hi havia prou PABA, de manera que els bacteris auxotròfics no podien créixer en un període de 72h a 37 °C en agitació. L’excepció, però, era en els tubs que havien rebut el substrat de Lossen sense catalitzador.
Johnson et al. investigaren la base d’aquest rescat auxotròfic. Observaren que sense presència de cèl·lules, el reactiu de Lossen podia generar PABA. Dels components del medi M9 el que era realment essencial per al rescat auxotròfic era el fosfat.
L’anàlisi espectrofotomètrica mostrava que la major densitat òptica a 600 nm s’assolia en cultius on hi havia substrat de Lossen i FeCl2, ferroïna o Fe(acac)3. El rol de catalitzador de ferro, no rauria tant en la reacció de Lossen com en l’aportació de ferro.
En les condicions citades també hi ha rescat auxotròfic de E. coli BW25113∆pabA i d’E. coli BW25113∆aroC, però d’una forma menys potent que en E. coli BW25113∆pabB. En aquesta darrera soca la reordenació de Lossen fomenta el consum de substrats.
La bioremediació de PET
Johnson et al. observaren que el substrat de la reordenació de Lossen pot produir-se a partir de la despolimerització de PET, concretament a partir d’àcid tereftàlic. L’interès per aquesta via és evident. La producció industrial de PET puja actualment a 56 milions de tones anuals. El 80% del PET entra en la fabricació d’article d’un sol ús, la qual cosa suposa la generació anual de 24 milions de tones de PET residual. Aquest residu de PET o bé és incinerat, o bé és conduït a abocadors.
Johnson et al. dissenyaren un sistema alimentat a partir d’ampolles de plàstic residuals de PET. La hidròlisi d’escates de PET genera àcid tereftàlic que, a través de l’acoblament d’amida amb triflat d’O-Piv hidroxilamoni i anhídrid de propilfosfònic (T3P) genera PET-1. Aquest substrat és capaç de garantir el rescat auxotròfic de E. coli BW25113∆pabB.
La interfície metabòlica
La reordenació de Lossen és biocompatible i aplicable a la generació de substrats derivats de PET. Johnson et al. estudiaren diferents substrats que afegiren als cultius d’E. coli BW25113∆pabB. El reordenament de Lossen troba una interfície amb el creixement cel·lular i amb reaccions biosintètiques.
Com que el rescat auxotròfic es fa a través de la generació de PABA, Johnson et al. investigaren si podien acoblar-la a la síntesi d’algun producte d’interès industrial. Pensaren primerament en el paracetamol, ja que és el tractament de primera línia que recomana l’OMS per al dolor i la febre. Actualment el paracetamol es fabrica a través de fenol derivat de combustibles fòssils (procés de cumè), mitjançant nitració, reducció i N-acetilació.
Hi ha dos enzims que poden convertir PABA en paracetamol:
- ABH60, enzim de Agaricus bisporus.
- PANAT, enzim de Pseudomonas aeruginosa.
De fet, hom ja havia aconseguit E. coli capaç de fer la biosíntesi de paracetamol a partir de D-glucosa.
Johnson et al. optaren per la resíntesi i clonació dels gens ABH60 i PANAT en un vector JUMP generador del plàsmid pSWL112. Mitjançant una flipasa codificada en pCP20, eliminaren la cassette de resistència a la kanamicina d’E. coli Keio BW25113∆pabB, i transformaren la soca resultant amb pSWL112.
Els cultius de BW25113∆pabB_pSWL112 eren capaços, segons mostrava l’anàlisi d’HPLC, de sintetitzar àcid 4-acetamidobenzoic. Això no era el que esperaven aconseguir Johnson et al., de manera que dissenyaren uns altres plàsmids JUMP amb gens abh60 i panat situats sota el control de promotors constitutius o induïbles. Les soques resultants sí eren capaces de generar paracetamol.
Johnson et al. treballaren amb les soques E. coli BW25113ΔpabB_p354 i E. coli BW25113ΔpabB_p350. Alimentades amb residus de PET, aquestes soques eren capaces de fer un rendiment del 83% en producció de paracetamol. Aquest rendiment era augmentat a través d’una reducció de la concentració d’arabinosa durant l’expressió proteica.
Encara hi ha marge de millora. Una optimització d’aquesta nova via metabòlica pot passar per l’aprofitament d’altres cascades quimio-enzimàtiques i per una major integració en els microorganismes.
Lligams:
- A biocompatible Lossen rearrangement in Escherichia coli. Nick W. Johnson, Marcos Valenzuela-Ortega, Thomas W. Thorpe, Yuta Era, Annemette Kjeldsen, Keith Mulholland & Stephen Wallace. Nature Chemistry (2025).
Cap comentari:
Publica un comentari a l'entrada