Epigenòmica: La immunodeficiència variable comuna (CVID) és la immunodeficiència primària simptomàtica més prevalent en les poblacions humanes. La base cel·lular és una deficiència en la diferenciació terminal dels limfòcits B i, com a conseqüència d’això apareix la base molecular, que són respostes defectives en la formació d’anticossos. És una malaltia hereditària, però els al·lels causants tenen una penetrància genètica incompleta, en el sentit que no sempre condueixen a la CVID i, quan ho fan, no ho fan amb la mateixa intensitat fenotípica. L’exemple més extrem d’això el trobem en bessons monozigòtics, que comparteixen tot el genoma i, que, malgrat això, són discordants per a la CVID, de manera que un dels bessons és diagnosticat d’aquesta malaltia i l’altre no gens. Així doncs, a més dels factors genètics, hi ha mecanismes patogènics addicionals. Javier Rodriguez-Ubreva i Esteban Ballestar, de l’Institut Josep Carreras de Recerca de la Leucèmia, i Roser Vento-Tormo, del Wellcome Sanger Institute, són els autors corresponsals d’un article, publicat a Nature Communications, sobre aquests mecanismes patogènics addicionals de la CVID. Rodriguez-Ubreva et al. han generat un cens epigenòmic i transcriptòmic de cèl·lules individuals que abasta la diferenciació dels limfòcits B en una parella de bessons monozigòtics discordants per a la CVID. Identifiquen defectes en les cèl·lules B de pacients de CVID en la metilació d’ADN, l’accessibilitat de la cromatina i la transcripció, que serien a la base dels defectes en la comunicació intercel·lular durant el procés d’activació de la cèl·lula B. A banda de l’estudi de bessons, Rodriguez-Ubreva et al. validen aquestes troballes en una cohort de pacients de CVID i de persones sanes. Les dades de l'estudi s’integren a l’Atles de la Cèl·lula Humana, amb la intenció d’ajudar al diagnòstic i tractament de la CVID.
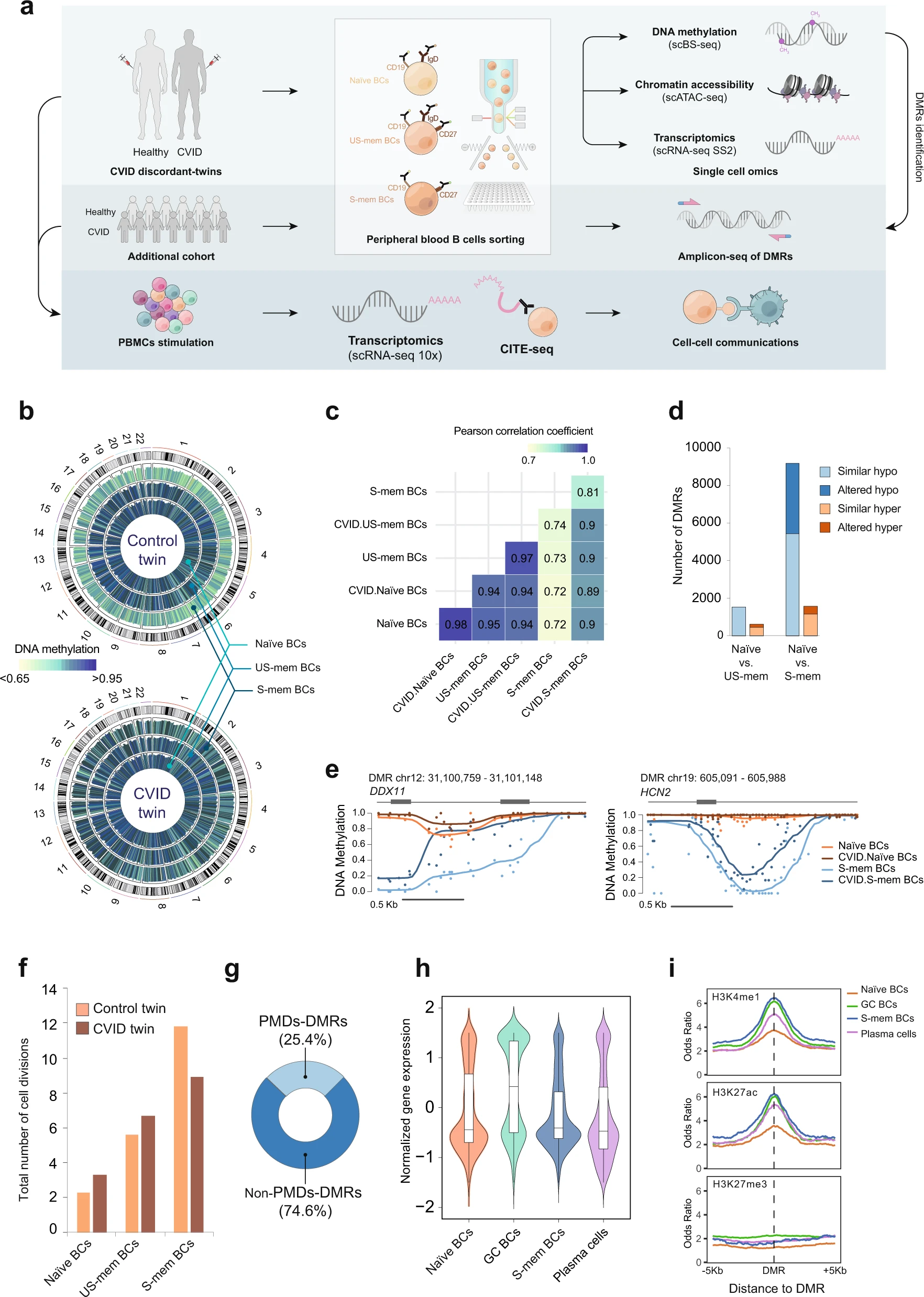
Rodriguez-Ubreva et al. han estudiat l’epigenòmica i transcriptòmica de limfòcits B aïllats d’una parella de bessons discordants per a la immunodeficiència variable comuna, així com d’altres pacients de la malaltia i de controls sans.
La immunodeficiència variable comuna
La immunodeficiència variable comuna (CVID) es caracteritza per uns nivells baixos d’immunoglobulina (gammaglobulina) sèrica, deficiències en la producció d’anticossos i un augment de la susceptibilitat a infeccions bacterianes respiratòries i gastrointestinals. És la immunodeficiència primària més freqüent, però entre la CVID hi ha una notable heterogeneïtat. La majoria, però no tots, tenen una baixa freqüència de limfòcits B de memòria. Els limfòcits B són els responsables de la síntesi d’anticossos, i la subpoblació de memòria és la que explica la capacitat del sistema immunitari humoral de respondre a patògens amb els qui l’organisme ja ha tingut contacte previ. Malgrat que la CVID és essencialment una immunodeficiència humoral (és a dir, una immunodeficiència anticossos), també pot haver-hi afectació de la immunodeficiència cel·lular (la mitjançada per limfòcits citotòxics i altres tipus cel·lulars).
Habitualment, la CVID es presenta de manera esporàdica, és a dir en pacients que no tenen cap historial familiar d’immunodeficiència. Vora un 10% dels pacients de CVID, però, tenen parents de primer grau que són hipogammaglobulinèmics o que presenten deficiència en la IgA (les immunoglobulines de mucoses).
En les darreres dècades, el coneixement de la genètica de la CVID ha aprofitat les noves tècniques de seqüenciació. Així s’ha identificat tota una sèrie de gens implicats directament en la CVID. No obstant, tan sols en un 20% dels pacients de CVID és possible assenyalar una causa monogènica concreta. Alhora, els al·lels de CVID no solen presentar una penetrància completa, és a dir que la seva presència no evoca CVID en tots els portadors.
Així doncs, en la CVID deuen actuar altres mecanismes més enllà dels monogènics. Una possibilitat és la interacció entre diverses gens (mecanisme poligènic). Una altra és que factors ambientals hi influeixin. A mig camí de les dues apareixen els mecanismes epigenètics, és a dir les modificacions de l’ADN que no n’afecten la seqüència nucleotídica.
Els estudis de bessons poden ajudar a escatir aquests mecanismes. Sovint, quan un bessó monozigòtic és diagnosticat de CVID, el seu germà no presenta cap signe de la malaltia. Els bessons monozigòtics comparteixen la mateixa genètica, però no pas necessàriament l’epigenètica. Així, s’ha trobat en alguna parella discordant alteracions en la metilació d’ADN.
L’epigenòmica suposa anar a un pas més enllà de l’epigenètica clàssica. Si l’epigenètica clàssica investiga una sèrie limitada de llocs CpG que poden ésser metilats o no, l’epigenòmica vol abastar-ne tot el conjunt. A més de la metilació d’ADN, considera també altres canvis epigenètics.
La transcriptòmica consisteix en l’estudi integral de l’ARN missatger d’un organisme, és a dir de com es transcriu el genoma d’ADN a ARN. L’epigenòmica, en general, és un dels determinants de la transcriptòmica.
Mentre que la genòmica pot fer-se, en termes generals, sobre qualsevol teixit, l’epigenòmica i la transcriptòmica són dependents de tipus cel·lular. Així doncs la transcriptòmica i l’epigenòmica sobre cèl·lules aïllades constitueix una eina potent per seguir processos de diferenciació. En la CVID, l’òmica unicel·lular pot oferir una finestra a la diversitat, plasticitat i adaptabilitat de les diferents cèl·lules immunitàries, i particularment de la diferenciació i maduració de les cèl·lules B.
Rodriguez-Ubreva et al. han fet epigenòmica unicel·lular a dos nivells, la metilació d’ADN i l’accessibilitat de la cromatina. La integren, a més, a la transcriptòmica unicel·lular. Ho fan sobre una parella discordant de bessons monozigòtics per a la CVID, i per a una cohort de 10 pacients i 10 donants sans. Les llurs dades indiquen alteracions prevalents i generalitzades en la metilació d’ADN i l’accessibilitat de cromatina en cèl·lules B de memòria, que tenen un impacte la transcriptòmica d’aquestes cèl·lules ulterior a l’activació. Les alteracions epigenètiques i transcripcionals poden ésser a la base d'alteracions en la comunicació intercel·lular.
Les mostres de sang
Rodríguez-Ubreva parteixen de mostres de sang d’una parella de bessons monozigòtics discordant per a CVID que ja ha participat en estudis previs. La validació la fan amb una cohort de 10 pacients de CVID i de 10 donadors sans. El diagnòstic de CVID es fa d’acord amb el criteri de la Societat Europea d’Immunodeficiències (ESID). Les mostres foren recollides al Hospital Universitario Doctor Negrín de Gran Canaria, i al Hospital La Paz de Madrid. Tots els donants reberen informació oral i escrita sobre la possibilitat que la sang donada fos utilitzada amb finalitats de recerca. Abans de la primera extracció, els pacients signaven un formulari de consentiment aprovat pel comitè ètic del centre hospitalari. El protocol per aïllar cèl·lules B de les mostres de sang fou aprovat el 9 de març del 2017 pel comitè ètic de l’Hospital Universitari de Bellvitge.
En primer lloc, de la mostra de sang s’aïllen cèl·lules mononuclears amb un gradient de Ficoll. Les cèl·lules eren tenyides amb anticossos anti-CD19, anti-CD27 i anti-IgD per tal de recuperar subpoblacions de limfòcits B naïve, de memòria inactiva i de memòria activada.
Les cèl·lules mononuclears de sang (PBMCs) eren activades in vitro amb una combinació de CD40L i IL-21 (estimulació B) o bé amb α-CD3/CD28 (estimulació T). Les cèl·lules activades eren tenyides amb anticossos anti-CD19.
De la parella de bessons discordants es realitzà una anàlisi de seqüència genòmica completa. Els resultats no s’han fet públics en les bases de dades d’acord amb les regulacions ètiques.
L’assaig de cercle de deleció l’intró κ, recombinació i excissió (KREC) permet, a partir de l’ADN aïllat d’una cèl·lula B, deduir el seu historial de replicació.
Cèl·lules aïllades eren vehiculades a un tampó de lisi d’un volum de 12 μl. Els lisats cel·lulars eren sotmesos a un conversió amb bisulfit. Hi seguia la purificació de l’ADN, i la seqüenciació. La tècnica de bisulfit permet discriminar el nivell de metilació de llocs CpG individuals. Paral·lelament, la seqüenciació d’ARN ofereix dades transcriptòmiques.
La seqüenciació unicel·lular ATAC permet identificar les regions de cromatina accessibles a transposasa.
Les alteracions en la metilació d’ADN en la CVID que afecten la diferenciació de cèl·lules B de memòria
L’anàlisi genòmica de la parella discordant de bessons per a la CVID no indicava la presència de cap les mutacions patogèniques descrites a la bibliografia. La seqüenciació genòmica amb bisulfit de 200 cèl·lules individuals sí identificava alteracions en la metilació d’ADN associades a la CVID.
És interessant remarcar que, malgrat ésser bessons monozigòtics, en l’anàlisi genòmica Rodríguez-Ubreva et al. hi troben 1400 variants somàtiques. Aquesta xifra és en consonància amb el que troba en bessons monozigòtics. Entre les 1400 variants, hi ha dos SNPs (VCV000332641.2 i VCV000670396.1) i dos insercions/delecions (VCV000801645.1 i VCV000402355.1) que podrien ésser clínicament rellevants. Una d’elles induiria un efecte rellevant en el gen TAS2R31.
Malgrat que els bessons no presenten cap mutació associada prèviament a la CVID, sí que presenten variants genètiques compartides per gens relacionats amb la CVID, com ara CR2, NFKB2, CD19 i TNFRSF13B. Potser ací es trobaria la base genètica del cas concret de CVID que afecta un dels dos bessons.
Les dades metilòmiques indiquen que en el bessó control, els nivells de metilació d’ADN davallen en les cèl·lules B de memòria respecte les cèl·lules B naive. Això va en consonància amb la desmetilació progressiva associada a la diferenciació de cèl·lula B.
En el bessó amb CVID, les cèl·lules B de memòria activada mostren una insuficient desmetilació per tot el genoma. En canvi, els nivells de metilació de les cèl·lules B naïve i les cèl·lules B de memòria inactiva són comparables als del bessó control.
En la transició de la cèl·lula B naïve a la cèl·lula B de memòria inactiva hi ha 1537 regions diferencialment hipometilades, i 628 regions diferencialment hipermetilades. En la CVID, de les 628 regions, n’hi ha 192 que no són hipermetilades.
Si hom contempla la transició de cèl·lules B naïve a cèl·lules B de memòria activada, el bessó amb CVID s’aparta en el 40,7% de les regions hipometilades i en el 26% de les regions hipermetilades. Aquestes alteracions no es deuen a una abundància diferencial de subtipus de cèl·lula B, ja que les proporcions de cèl·lules IgG+ i IgA+ en el compartiment de cèl·lules de memòria són semblants entre els dos bessons.
Així doncs, les alteracions en el metiloma associades a la CVID no apareixen en les cèl·lules B naïve, sinó en el procés de diferenciació cap a cèl·lules B de memòria, i afecten únicament regions genòmiques específiques.
Les cèl·lules B de memòria activada del bessó amb CVID presenten una menor taxa de divisió cel·lular. L’afectació de la metilació es produiria en les cèl·lules B de centres germinals. Les regions genòmiques afectades se situaria principalment en posicions intròniques i intergèniques.
El deteriorament del programa de desmetilació en la diferenciació de cèl·lules B mostra una heterogeneïtat en diferents cèl·lules. En general, totes les cèl·lules analitzades del bessó amb CVID mostren alteracions de metilació però la freqüència d’aquestes alteracions és altament variable.
Les alteracions en la metilació afecten especialment diversos factors de transcripció implicats en la diferenciació i funcionalitat de la cèl·lula B com són BATF, JUNB, FosI2, Fra2, p65, p50, etc.
Modificacions en l’accessibilitat a cromatina i en la transcripció
Les diferències entre els dos bessons pel que fa a l’accessibilitat de la cromatina es concentren en les cèl·lules B de memòria activada. De nou, aquests canvis comporten que en el bessó amb CVID s’hi vegin afectats factors de transcripció.
De tota manera, els perfils de transcripció entre els dos bessons són semblants tant en les cèl·lules B naïve com les cèl·lules B de memòria. En les cèl·lules B naïve, però, poden identificar 870 gens sobreexpressats i 11 gens infraexpressats en el bessó amb CVID. Aquesta xifra puja respectivament a 5116 gens sobreexpressats i 179 infraexpressats en cèl·lules B de memòria activada. Entre els gens sobreexpressats hi ha FCGR2B, CD72, PTPRC, CD79A, CD22, i CCR6, mentre que entre els gens infraexpressats hi ha CCL22, CD40, ICAM1, CCR7, CCL17, CD80, i CD86.
Canvis en la comunicació intercel·lular
Les alteracions en les cèl·lules B del bessó amb CVID s’associen amb alteracions en altres tipus de cèl·lules immunitàries (NK, T, etc.). Això s’explicaria per canvis en la comunicació intercel·lular, tant la vehiculada per contacte directe com la vehiculada per citocines.
Canvis epigenètics, transcripcionals i de comunicació intercel·lular en una cohort de CVID
L’anàlisi de 10 pacients diferents de CVID que abasten els tres subtipus de la malaltia (Ia, Ib i II) permeten veure quins dels canvis epigenètiques, transcripcionals i intercel·lulars detectats en el bessó amb CVID són generalitzables. La insuficient hipometilació és comuna a tots els pacients, però és especialment accentuada en el tipus Ib (al qual pertany el bessó de l’estudi). També és comuna la deficient taxa de proliferació entre les cèl·lules B.
Rodríguez-Ubreva et al. posen les bases per a la identificació d’una episignatura diagnòstica de la CVID. Entre els factors de transcripció més comunament afectats en les cèl·lules B de pacients de CVID hi hauria Fra1, IRF8 o CTFC. Els canvis transcriptòmics, però, s’evidenciarien especialment arran de l’activació de la cèl·lula B.
La CVID no tan sols tindria un impacte en les cèl·lules B, sinó també en altres tipus cèl·lulars, com els limfòcits reguladors T CD4+.
Rodríguez-Ubreva consideren necessaris estudis amb cohorts més àmplies de pacients de CVID. A més dels estudis sobre cèl·lules immunitàries aïllades de mostres de sang, caldria considerar l’estudi de cèl·lules directament procedents d’òrgans limfoides o de moll de l’os. Una altra línia de recerca és l’exposòmica, és a dir la d’entendre quins factors ambientals poden conduir al desenvolupament de la CVID. Bessons monozigòtics són sotmesos a exposicions lleugerament diferents en el desenvolupament prenatal, que s’amplifiquen en la vida post-natal, i que es tradueixen en canvis epigenètics.
Lligams:
- Single-cell Atlas of common variable immunodeficiency shows germinal center-associated epigenetic dysregulation in B-cell responses. Javier Rodríguez-Ubreva, Anna Arutyunyan, Marc Jan Bonder, Lucía Del Pino-Molina, Stephen J. Clark, Carlos de la Calle-Fabregat, Luz Garcia-Alonso, Louis-François Handfield, Laura Ciudad, Eduardo Andrés-León, Felix Krueger, Francesc Català-Moll, Virginia C. Rodríguez-Cortez, Krzysztof Polanski, Lira Mamanova, Stijn van Dongen, Vladimir Yu. Kiselev, María T. Martínez-Saavedra, Holger Heyn, Javier Martín, Klaus Warnatz, Eduardo López-Granados, Carlos Rodríguez-Gallego, Oliver Stegle, Gavin Kelsey, Roser Vento-Tormo & Esteban Ballestar. Nature Communications 13: 1779 (2022).

Cap comentari:
Publica un comentari a l'entrada