Enginyeria genètica: Fa més de quatre dècades el llavors ministre de Sanitat i Consum d’Espanya, Jesús Sancho Rof, es va referir a la hipòtesi d’un micoplasma com a agent causal de la síndrome tòxica provocada per una partida adulterada d’oli de colza dient que “era un bichito del que conocemos el nombre [Mycoplasma] i el primer apellido [pneumoniae]. Nos falta el segundo. Es tan pequeño que, si se cae de la mesa, se mata”. Aquesta atribució causal de la síndrome tòxica era falsa, però situà al Mycoplasma pneumoniae en l’imaginari de les coses fràgils: un bacteri petit i sense paret cel·lular, enormement auxotròfic i desemparat, però alhora causant de pneumònies atípiques. El Grup de Recerca de Luis Serrano Pubul i Maria Lluch Senar del Centre de Regulació Genòmica de Barcelona ofereixen amb el projecte empresarial Pulmobiotics una mena de redempció del “bichito”. El genoma extremadament reduït dels micoplasmes els fa candidats a l’enginyeria genòmica, i el seu tropisme pulmonar pot ésser reaprofitat en el disseny de bioteràpies. Aquesta setmana la revista Nature Biotechnology publica un article que té a Serrano i a Lluch-Senar com a autors corresponsals, i a Rocco Mazzolini i Irene Rodríguez-Arce com a primers autors en el que presenten una bioteràpia consistent en una versió modificada de Mycoplasma pneumoniae destinada a tractar la pneumònia associada a la ventilació assistida. Aquesta pneumònia presenta una alta mortalitat hospitalària quan s’associa a la formació de biofilms de Pseudomonas aeruginosa. La base de la bioteràpia és una forma atenuada de Mycoplasma pneumoniae el genoma del qual ha estat reduït al xassís. Mazzolini et al. han validat la bioseguretat d’aquest bacteri modificat en ratolins. Sobre aquest xassís han introduït per transposició quatre transgens que confereixen al microplasma activitats bactericides i de degradació de biofilms. En un model de ratolí comproven que aquest micoplasma transgènic té una alta eficàcia contra la infecció aguda de pulmó per P. aeruginosa. El micoplasma transgènic s’ha mostrat eficaç en la dissolució de biofilms formats en tubs endotranqueals de pacients amb pneumònia associada a ventilador. Aquesta bioteràpia es combinaria amb antibiòtics adreçats a la capa de peptidoglicà per augmentar l’eficàcia contra bacteris grampositius i gramnegatius. Com que els micoplasmes no tenen paret bacteriana, aquests antibiòtics no els afecten. El pas que queda endavant és constatar si aquesta bioteràpia és capaç de tractar infeccions respiratòries associades a biofilms bacterians.
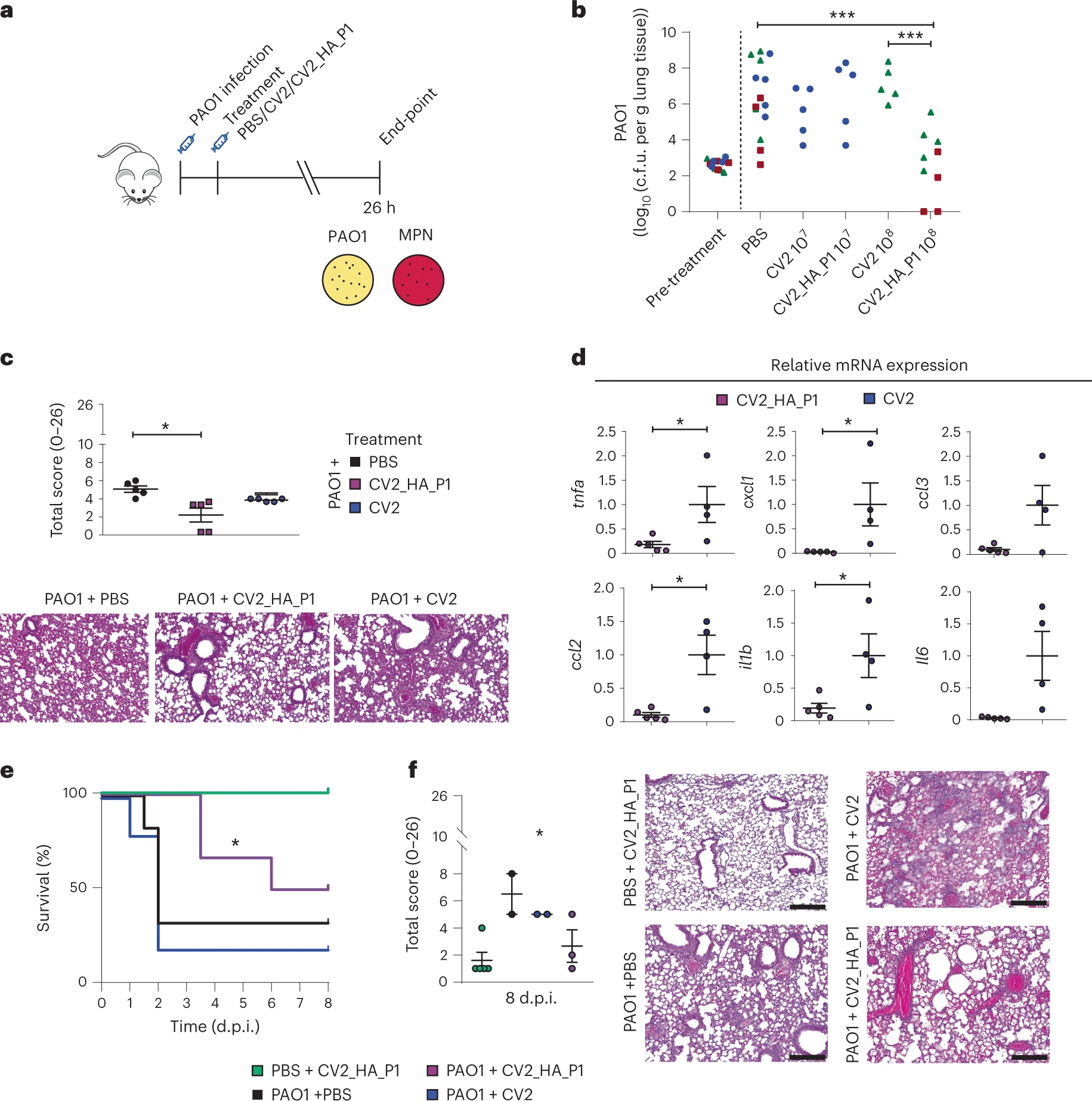
Mazzolini et al. han estudiat en un model experimental de ratolins immunocompromesos CD1 infectats amb “Pseudomonas aeruginosa” PAO1 la capacitat de la soca CV2 HA modificada de “Mycoplasma pneumoniae” de reduir l’afectació pulmonar
Infeccions respiratòries associades a biofilms
Mazzolini i Rodríguez Arce, del CRG de Barcelona, dissenyaren i realitzaren experiments, analitzaren dades i redactaren l’article. Laia Fernández-Barat (del Laboratori Cellex de l’IDIBAPS), Carlos Piñero-Lambea (CRG) i Victoria Garrido (CRG) també dissenyaren i realitzaren experiments. Agustín Rebollada-Merino (del Centro de Vigilancia de Salud VISAVET de la Complutense de Madrid) i Anna Motos (IDIBAPS) analitzaren dades. Antoni Torres (IDIBAPS) i Maria Jesús Grilló (del Instituto de Agrobiotecnología de Navarra) donaren suport tècnic i assessorament conceptual. Serrano i Lluch-Senar dissenyaren experiments, analitzades dades, donaré suport tècnic i assessorament conceptual, redactaren l’article i lideraren el projecte. La recerca fou finançada amb fons europeus del projecte MYCOCHASSIS i pel projecte MycoSynVac. L’article fou tramès a Nature Biotechnology el 22 de març del 2021. Després d’un llarg procés de revisió, l’article fou acceptat el 21 d’octubre del 2022, i publicat el 19 de gener del 2023.
Les malalties respiratòries es troben entre les deu causes principals de mortalitat al món. El tractament basat en antibiòtics ha de fer front a l’augment d’incidència de bacteris que són resistents a aquests fàrmacs antimicrobians que no és compensat pel desenvolupament de nous antibiòtics. Hom ha assenyalat també que l’ús d’antibiòtics té un efecte perjudicial per a la microbiota normal de les vies respiratòries i els beneficis que aquesta comporta. La majoria d’infeccions humanes (65-80%) s’associa amb biofilms, és a dir pel·lícules de microorganismes. Són especialment rellevants aquests biofilms en malalties pulmonars cròniques com la fibrosi cística, la malaltia pulmonar obstructiva crònica o la bronquièctasi. També ho són en infeccions agudes com la traqueobronquitis o la pneumònia associades a ventilació artificial.
La formació de biofilms per part dels bacteris constitueix per a ells una estratègia de supervivència contra estrès ambiental. Els biofilms són estructures complexes i dinàmiques consistents en agregats de cèl·lules microbianes immerses en una matriu polimèrica. Tant els components del sistema immunitari com els antibiòtics tenen més difícil arribar a bacteris integrats en biofilms. Augmentar la dosi d’antibiòtic en aquests casos pot comportar danys renals o hepàtics i resultar inútil quan, com passa sovint, les soques bacterianes que els formen són inherentment resistents a aquests antibiòtics.
La ventilació mecànica invasiva en unitats de cures intensives implica la utilització de tubs endotraqueals. Aquests tubs poden ser colonitzats per biofilms. En el cas de pacients de covid-19 que requereixen ventilació mecànica invasiva vora el 50% acaben per patir infeccions agudes associades a aquests biofilms. Entre els microorganismes que formen aquests biofilms resulta especialment preocupant Pseudomonas aeruginosa.
És davant d’aquesta darrera amenaça que Mazzolini et al. han desenvolupat aquesta bioteràpia basada en un bacteri modificat. La base d’aquest bacteri és Mycoplasma pneumoniae, un organisme que es descrigué com a causant de pneumònies atípiques (és a dir aquelles que no són causades per Streptococcus pneumoniae o Klebsiella pneumoniae) i d’altres patologies extrapulmonars. La pneumònia atípica per micoplasma fou una de les complicacions que serviren al diagnòstic inicial de la síndrome d’immunodeficiència adquirida. El genoma de M. pneumoniae és relativament petit, de 816 milers de parells de nucleòtids. És un patogen relativament lleu contra el qual hom disposa d’antibiòtics efectius. És un bacteri molt ben estudiat en el laboratori en tant que és el model més habitual de micoplasma. La xarxa metabòlica i genètica d’aquest microorganisme és relativament senzilla. Com que els micoplasmes no tenen paret bacteriana no desencadenen una resposta inflamatòria forta i són resistents als antibiòtics que ataquen la capa de peptidoglicà de la paret cel·lular. El coneixement molecular ha permès identificar els principals antígens i factors de virulència d’aquesta espècie. La soca M129 de M. pneumoniae té una baixa taxa de recombinació la qual cosa li confereix una estabilitat genètica. Una peculiaritat del codi genètic del micoplasma, en el que el codó UGA respon a triptòfan i no a l’aturada de síntesi proteica, forneix un mecanisme de biocontenció. Hom coneix també els requeriments de creixement, i se’l pot fer créixer a escala industrial en un medi definit, sintètic, sense necessitat d’afegir-hi sèrum.
Mazzolini et al. empren com a xassís una versió modificada i atenuada de M. pneumoniae M129, dissenyada per combatre infeccions pulmonars causades per P. aeruginosa. En aquest treball, d’entrada, caracteritzaren in vivo la seguretat d’ús i supervivència de diferents soques M129 en pulmons de ratolí. A la soca seleccionada l’introduïren dos sistemes genètics optimitzats: 1) un que combina activitats de dispersió de biofilm, amb les hidrolases PelAh i PslGh, i la liasa d’alginat A1-Il’; 2) un altre que confereix activitat antimicrobiana, amb els gens de la piocina L1 i de la piocina S5. L’activitat antibiofilm d’aquest bacteri modificat fou validada en models in vitro, ex vivo i in vivo. Així, el micoplasma modificat podia reduir una infecció aguda de P. aeruginosa en un model de ratolí. També podia dissoldre biofilms formats in vivo en tubs endotraqueals de pacients quan se’l combinava amb antibiòtics.
M. pneumoniae en pulmons de ratolins
Mazzolini et al. estudiaren inicialment la supervivència de la soca salvatge de M. pneumoniae en pulmons de ratolins CD1. Cultius de micoplasma eren inoculats per via intratraqueal o intranasal. La càrrega bacteriana resultant era determinada en fluid de rentat pulmonar i broncoalveolar al cap de dos dies de la inoculació. Així observaren que la càrrega bacteriana era més alta quan la inoculació era intratraqueal. Al cap de quatre dies la càrrega bacteriana s’havia reduït a l’1% respecte del valor màxim dels dos dies de la infecció, i al cap de catorze dies els valors eren quatre ordres de magnitud inferiors al valor màxim.
El pas següent era aconseguir una soca de M. pneumoniae sense gens patogènics. Entre els gens seleccionats per a l’eliminació contemplaren mpn372 (que codifica una toxina), mpn133 (que codifica una lipoproteïna amb activitat nucleasa), mpn453 (que codifica la proteïna adhesina P30) i mpn051 (que codifica l’enzim GlpD). La deleció del gen mpn051 resulta en soques que creixen poc in vitro, ja que sense l’enzim GlpD, el micoplasma no pot aprofitar la fosfatidilcolina com a font de carboni. La soca CV2 té delecions en els gens mpn372 i mpn133: és una soca que es demostra atenuada en un model d’infecció de glàndula mamària. Mazzolini et al. afegiren a la soca CV2 la deleció del gen mpn453. Aquesta soca amb tres gens patogènics delecionats es demostra com menys infectiva que la soca original en la infecció pulmonar de ratolins. Fent equilibris, Mazzolini et al. optaren per la soca CV2, la qual conserva els gens patogènics mpn453 i mpn051.
La soca CV2 produeix una infecció pulmonar en ratolins tan productiva com la soca originària.
Lesions pulmonars i resposta inflamatòria induïda per la soca CV2
Mazzolini et al. han seguit en ratolins infectats les lesions pulmonars (avaluades histopatològicament) i la resposta inflamatòria (mesurada com a perfil de citocines). A 2 dies d’infecció la soca CV2 genera lesions més lleus que la soca originària WT, amb menys signes d’inflamació peribronquiolar i perivascular, i menys inflamació intersticial. A 14 dies les lesions ja resulten inexistents.
El perfil de citocines era avaluat per una tècnica de RT-qPCR, és a dir de l’expressió dels gens corresponents. La soca CV2 no produïa una sobreexpressió d’aquests gens, ni tan sols en el pic de la infecció.
La introducció de gens per dissoldre biofilms de P. aeruginosa
Sobre la soca CV2, Mazzolini et al. han introduït un casset genètic que expressa tres enzims que ataques polisacàrids de biofilms de P. aeruginosa: PelAh, PslGh i A1-Il’. Aquests tres gens es troben fusionats en aquest casset a un pèptid de secreció. En cultius la CV2_HA resultant secreta aquests tres enzims. Els sobrenedants dels cultius presenten activitat antibiofilm, evidenciada tant quan es tenyeixen els biofilms amb cristall violeta com si s’utilitza blau alcià. La soca CV2_HA és capaç de promoure la dispersió de biofilms formats per les soques SAT290 i PAO1 de P. aeruginosa.
L’addició d’activitat antimicrobiana a CV2_HA
Mazzolini et al. introdueixen també dos gens d’activitat antimicrobiana. En primer lloc introdueixen el gen de la bacteriocina piocina L1. Això li confereix la capacitat d’inhibir el creixement de la soca PAO1, encara que no de la soca Boston 41501.
En segon lloc li afegeixen el gen de la piocina S5. D’aquesta manera ja s’adquireix la capacitat d’inhibir el creixement de la soca Boston.
La soca CV2_HA_P1 en tubs endotraqueals de pacients amb pneumònia associada amb ventilació.
El material experimental eren seccions de tubs endotraqueals que s’havien fet servir en pacients amb pneumònia associada a ventilació mecànica invasiva. Mazzolini et al. comprovaren que CV2_HA_P1 té una activitat d’ampli espectre contra els biofilms formats per soques clíniques multiresistents de P. aeruginosa.
L’eficàcia de CV2_HA_P1 en un model murí d’infecció pulmonar
El model murí consistia en una infecció pulmonar aguda de la soca PAO1 en ratolins immunosuprimits amb l’administració prèvia de ciclofosfamida. La coinfecció amb CV2_HA_P1 resultava efectiva en la reducció de la càrrega de PAO1 en els pulmons dels ratolins, que es traduïa en una major supervivència.
En una altra sèrie d’experiments els ratolins prèviament la càrrega de CV2_HA_P1. La infecció de la soca PAO1 en aquests casos resultava atenuada.
La potencialitat de CV2_HA_P1 en el tractament d’infeccions respiratòries humanes associades ventilacions mecàniques invasives
L’experiment en tubs endotraqueals procedents de pacients indica la capacitat de CV2_HA_P1 per dissoldre biofilms. Els millors resultats s’aconseguien quan la bioteràpia es combinava amb antibiòtics estàndards. En certa manera, la soca CV2_HA_P1 era capaç de retornar l’efectivitat d’aquests antibiòtics front els biofilms de P. aeruginosa.
En l’horitzó de Pulmobiotics el xassís CV2 pot trobar aplicacions en diferents malalties pulmonars, tant infeccioses com no-infeccioses. Aquest xassís produeix una infecció aguda limitada en el temps, i es pot aprofitar per a la introducció de principis actius. Bastaria, en principi, amb introduir els gens corresponents en el xassís CV2, i els micoplasmes durien al pulmó bacteriocines, citostàtics o qualsevol altra mena d’agent terapèutic.
Lligams:
- Engineered live bacteria suppress Pseudomonas aeruginosa infection in mouse lung and dissolve endotracheal-tube biofilms. Rocco Mazzolini, Irene Rodríguez-Arce, Laia Fernández-Barat, Carlos Piñero-Lambea, Victoria Garrido, Agustín Rebollada-Merino, Anna Motos, Antoni Torres, Maria Jesús Grilló, Luis Serrano, Maria Lluch-Senar. Nature Biotechnology (2023).
Cap comentari:
Publica un comentari a l'entrada