Neurogenètica: En mamífers el sexe femení és el sexe homogamètic pel que fa als cromosomes sexuals. Això implica que cada cèl·lula femenina disposa de dos cromosomes X, un d’origen matern (Xm, derivat de l’òvul) i un altre d’origen patern (Xp, derivat de l’espermatozoide). No obstant, això en la immensa majoria de cèl·lules un dels dos cromosomes X esdevé permanentment inactivat. D’aquesta manera, en el cos de la femella hi ha un mosaicisme del cromosoma X, amb vora la meitat de cèl·lules expressant el cromosoma Xm i l’altra meitat expressant el cromosoma Xp. La variabilitat interindividual és notable, de manera que alguns individus tenen un biaix en favor del cromosoma Xm i d’altres a favor del cromosoma Xp. No tan sols és diferent la informació genètica de Xp i Xm, sinó que encara més dispars ho són en termes epigenètics, cosa explicable si atenem que el primer va passar per un procés d’espermatogènesi i el segon per un d’oogènesi. Les diferències epigenètiques es manifesten en patrons diferents de metilació de l’ADN, la qual cosa pot afectar l’expressió de gens. La professora de neurologia de la University of California San Francisco Dena Dubal ha liderat una recerca per conèixer el rol funcional del mosaicisme del cromosoma X. En un article publicat avui a Nature, amb Samira Abdulai-Saiku (UCSF) de primera autora, expliquen les dades d’un model de ratolí que únicament el cromosoma X matern (Xm). Abdulai-Saiku et al. troben que això té un impacte negatiu en la capacitat cognitiva al llarg de tota la vida, alhora que condueix a un empitjorament de l’envelliment cognitiu. Aquests dèficits cognitius s’acompanyen d’una acceleració de l’envelliment biològic i epigenètic de l’hipocamp. La base d’això seria el silenciament diferencial de gens en el cromosoma Xm, cosa que Abdulai-Saiku et al. mostren amb un rescat parcial mitjançant una tècnica CRISPR. Abdulai-Saiku et al. creuen que aquest model animal pot ajudar a entendre l’heterogeneïtat cognitiva femenina, i a explotar en general vies genètiques del cromosoma X que protegeixin contra dèficits cognitius i l’envelliment cerebral.
Abdula-Saiku et al. observen com ratolins femella que expressen únicament el cromosoma X tenen una menor capacitat cognitiva i pateixen un envelliment epigenètic accelerat del cervell
Un model de ratolins que tan sols expressen el cromosoma X matern
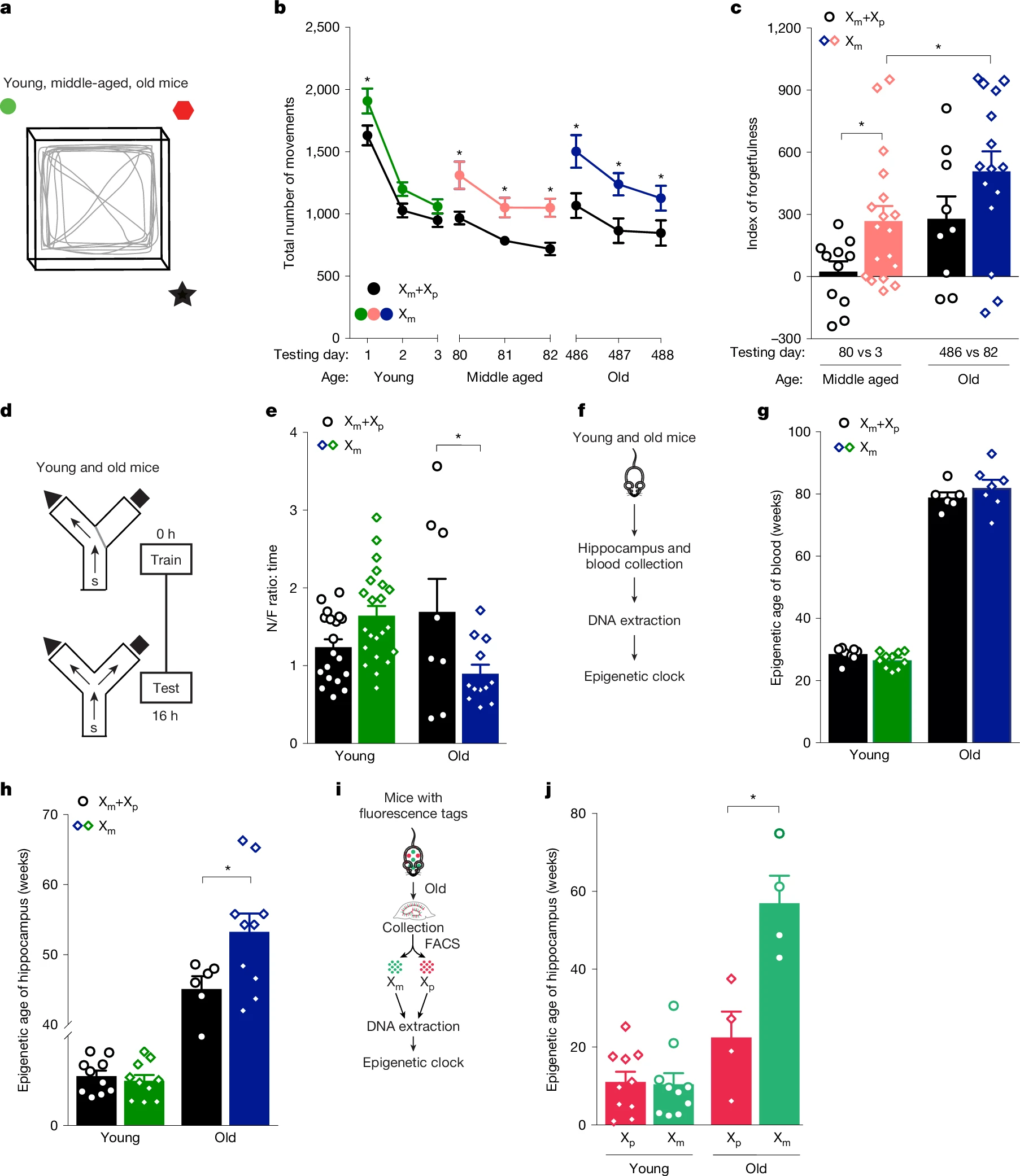
Abdulai-Saiku et al. denominen el seu model de ratolí ‘Xm’. Al llarg de l’estudi el comparen amb el model de mosaicisme normal, que denominen ratolí ‘Xm+Xp’. Els ‘ratolins Xm’ deriven de creuaments de ratolins amb una deleció dirigida en el gen Xist-loxP del cromosoma Xm, conduïda per una seqüència Cre específica de granulosa que permet que hi hagi una transmissió de línia germinal. La conseqüència d’aquest constructe gènic és un biaix cap a fer del cromosoma Xm l’únic actiu en les femelles resultants.
Els ratolins Xm i Xm+Xp tenen un mateix rerefons genètic, la soca congènica C57BL/6J. El biaix dels primers i el mosaicisme dels segons es comprova mitjançant una tècnica d’immunofluorescència. Cal recordar que el gen Xist no es transcriu e el cromosoma actiu, de manera que les diferències entre ratolins Xm+Xp i ratolins Xm s’han d’atribuir merament a influències epigenètiques.
Diferències funcionals generals entre ratolins Xm+Xp i ratolins Xm
Abdulai-Saiku et al. van criar camades de ratolins Xm+Xp i ratolins Xm fins a edats avançades. De les femelles d’aquests animals obtenien mesures corresponents a diferents sistemes orgànics. Per exemple, els nivells de glucèmia eren similars en tots dos casos, tant si es mesuraven en animals joves (4-8 mesos) com en animals vells (24-27 mesos). L’ecocardiografia en animals vells indicaven valors semblants. També ho era la composició corporal, la densitat òssia, la massa de teixit magre i el percentatge de greix. Ho eren també la ratio de bescanvi respiratori, la despesa energètica i el consum d’oxigen.
Diferències cognitives entre ratolins Xm+Xp i ratolins Xm
Abdulai-Saiku et al. recorden que el cromosoma X, tot i relativament petit i amb poc nombre de gens, és enriquit en gens implicats en la funció neural. Això es manifesta en la mateixa espècie humana en tot un seguit de deficiències intel·lectuals congènites amb una herència genètica vinculada al sexe que les fa molt més prevalents en el sexe masculí (recordem, el sexe heterogamètic XY).
En experiments de laberint aquàtic de Morris, Abdulai-Saiku et al. mesuren l’aprenentatge i la memòria espacials de ratolins joves de 4-8 mesos. Els resultats són semblants en ratolins Xm i ratolins Xm+Xp quan es fan amb una plataforma amagada. En canvi, quan la tasca consisteix en recordar la localització de la plataforma, els ratolins Xm mostren una menor memòria, manifestada en una major latència en localitzar la plataforma. No hi ha canvis entre els dos tipus de ratolins pel que fa a la velocitat de natació o a la capacitat de trobar una plataforma visible.
Les proves en el laberint elevat EPM indiquen que entre els dos tipus de ratolins no hi ha diferències en comportaments d’ansietat. Això indica que els ratolins Xm tenen una afectació específica de la memòria espacial.
En un test de camp obert, els ratolins Xm joves acaben per assolir un valors semblants a Xm+Xp després d’un procés d’habituació. En ratolins Xm de mitjana edat hi ha una major tendència a oblidar el cotext espacial, que encara es fa més greu en ratolins Xm d’edat avançada.
En la prova del laberint Y de dos intents, Abdulai-Saiku et al. avaluen els dèficits en la memòria de treball i en la memòria espacial. En edat juvenil, Xm i Xm+Xp assoleixen resultats semblants. En edat avançada, els ratolins Xm passen més temps en el braç familiar, indicatiu d’un empitjorament de la memòria més pronunciat que el que manifesten els ratolins Xm+Xp.
Diferències en l’envelliment cerebral
Abdulai-Saiku et al. centren seguidament l’atenció en l’hipocamp. És ben estudiat en ratolins el procés d’envelliment d’aquesta regió cerebral, que es pot seguir a través d’una sèrie de marcadors epigenètics de metilació de l’ADN. Abdulai-Saiku et al. estudien patrons de metilació en de 2045 gens específics tant en mostres de sang com d’hipocamp de ratolins joves i vells. Les mostres de sang mostren un envelliment epigenètic semblant en Xm i en Xm+Xp. En canvi, en les mostres d’hipocamp de femelles velles l’envelliment epigenètic de Xm és més pronunciat que en Xm+Xp.
Abdulai-Saiku et al. aprofiten un model transgènic de fluorescència neuronal mitjançada per Cre per poder distingir entre neurones que tenen actiu el cromosoma Xm (que marquen amb GFP) i neurones que tenen actiu el cromosoma Xp (que marquen amb tdTomato). Així en mostres d’hipocamp poden separar per citometria de flux entre neurones Xm i neurones Xp d’un mateix individu. En ratolins joves no hi ha diferències en marcadors d’envelliment epigenètic entre neurones Xm i neurones Xp. Ara bé, en ratolins vells, les neurones Xm presenten un major envelliment epigenètic que les neurones Xp. Això mostra que d’alguna manera l’activació del cromosoma X matern (Xm) té un impacte en l’envelliment de les neurones de l’hipocamp.
Abdulai-Saiku et al. connecten aquests resultats amb la síndrome de Turner en humans, on la configuració X0 consisteix justament en la presència exclusiva de cromosoma Xm. Les dones amb síndrome de Turner presenten dèficits cognitius.
Silenciament epigenètic pel cromosoma Xm
Abdulai-Saiku et al. entenen que aquest efecte del cromosoma Xm s’ha d’explicar per un silenciament gènic específic. Per investigar-ho apliquen una tècnica de seqüenciació d’ARN (RNA-seq) a ratolins transgènic femelles que tenen la configuració Xm(GFP)+Xp(tdT). Ho fan sobre mostres d’hipocamp de ratolins joves i vells, que separen en citometria de flux. La RNA-seq posa en evidència un total de 848 gens, d’entre el total de 1500 gens coneguts del cromosoma X.
El cromosoma Xm mostra el silenciament o repressió de nou gens, entre els quals hi ha Sash3, Tlr7 i Cysltr1. Aquest silenciament és present tant en ratolins joves com vells.
El cromosoma Xp mostra el silenciament de dos gens, Xlr3b i Trpc5.
Les dades de RT-qPCR dels gens Sash3, Tlr7 i Cysltr1 confirmen la baixa expressió en neurones que tenen actiu el cromosoma Xm.
L’activació de gens específics del cromosoma X al rescat
Abdulai-Saiku et al. dissenyaren una tecnologia d’activació CRISPR que promou en neurones l’expressió simultània dels gens Sash3, Tlr7 i Cysltr1. Validaren primer el procediment en cultius primaris de neurones de ratolí. En aquest model in vitro fan ús de vectors lentivirals que expressen dCas9 sota un promotor neuronal i sgRNAs sota un promotor ubicu. Al cap de dues setmanes les neurones transfectades expressen el doble aquests gens respecte a com ho feien abans.
Després transfectaren aquests vectors a l’hipocamp de ratolins femelles vells mitjançant injeccions estereotàxiques. Per immunohistoquímica comprovaren que els constructes de dCas9 i sgRNA eren expressats en el 10% de les neurones del gir dentat. Per citometria de flux comprovaren que una fracció petita de les neurones passaven a expressar els tres gens esmentats a un nivell més elevat: en aquestes neurones es produïa una estimulació de vies de producció energètica mitocondrial.
Una bateria de tests comportamentuals i cognitius indicaven que les femelles injectades amb el vector lentiviral augmentaven la capacitat d’aprenentatge espacial (laberint de Morris) i la memòria per localitzar la plataforma (laberint d’aigua).
Abdulai-Saiku et al. mostren, doncs, que les neurones d’hipocamp que tenen activat el cromosoma Xm pateixen pèrdues de funció degut al silenciament epigenètic de diversos gens. La restauració de l’expressió de tres d’aquests gens, Sash3, Tlr7 i Cysltr1, permet revertir-ne els efectes.
Lligams:
- The maternal X chromosome affects cognition and brain ageing in female mice.Samira Abdulai-Saiku, Shweta Gupta, Dan Wang, Francesca Marino, Arturo J. Moreno, Yu Huang, Deepak Srivastava, Barbara Panning & Dena B. Dubal. Nature (2025).
Cap comentari:
Publica un comentari a l'entrada