Psiquiatria molecular: Iain H. Campbell, Harry Campbell i Daniel J. Smith, del Centre for Clinical Brain Sciences de la University of Edinburgh proposen en un article a Translational Psychiatry que el liti exerciria el seu efecte terapèutic en el trastorn bipolar actuant sobre vies de senyalització de la insulina. S’hi refereixen específicament a la via de senyalització de la insulina a través de la PI3K/Akt. El liti actuaria sobre la GSK3 i el PI conduint a una estabilització de la conducta. Altres accions del liti (sobre la mateixa Akt, la PKC i els transportadors de mio-inositol sòdic) també passarien per la via de la insulina. Aquest mecanisme va en la línia dels estudis que indiquen que darrera del trastorn bipolar hi ha una desregulació energètica. Això darrer explicaria la co-morbiditat habitual entre el trastorn bipolar i la diabetis tipus 2 i altres malalties del metabolisme de la glucosa. Campbell et al. proposen l’ús de vesícules extracel·lulars per comprovar el rol de la senyalització neuronal de la insulina en pacients amb trastorn bipolar.
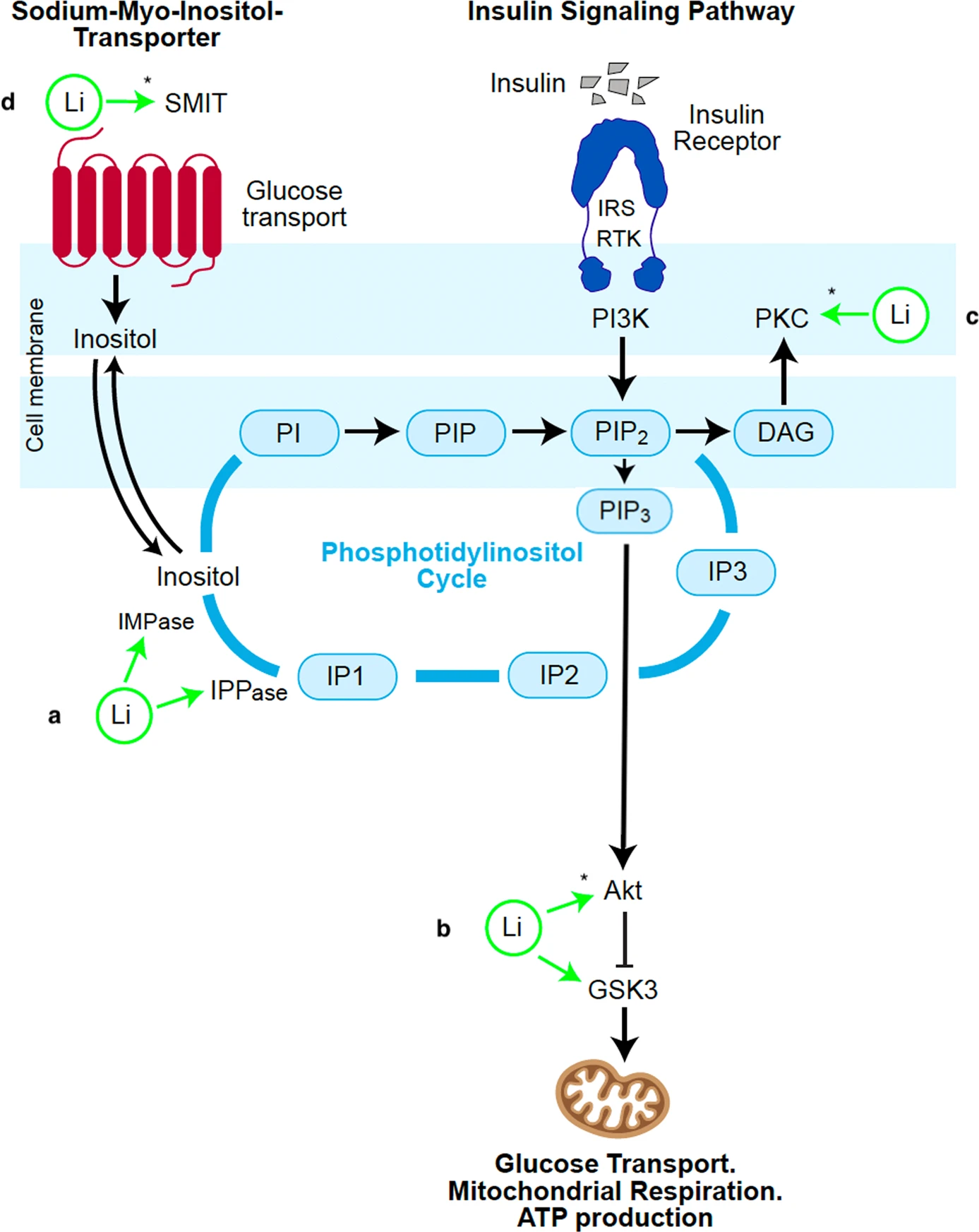
Mecanisme d’acció del liti en les vies de senyalització de la insulina proposat per Campbell et al.
Liti i trastorn bipolar
Iain H. Campbell concebé aquesta hipòtesi de la senyalització de la insulina i redactà el primer esborrany de l’article. Harry Campbell i Daniel J. Smith desenvoluparen els arguments d’aquesta hipòtesi i contribuïren a l’article final, que fou tramès a Translational Psychiatry el 20 de juny del 2022. Després d’una revisió completada el 9 d’agost, l’article fou acceptat el dia 16 i publicat el dia 29.
El liti és el tractament d’elecció en el trastorn bipolar. Des de fa 60 anys hom investiga el mecanisme d’acció que explica aquesta efectivitat. Campbell et al. avançaren en el seu moment la idea que darrera del trastorn bipolar hi ha una alteració del metabolisme de la glucosa i de la funció mitocondrial, caracteritzades per una disrupció de la fosforilació oxidativa i un augment de la glucòlisi. Ara consideren que aquestes alteracions s’expliquen millor com el resultat d’una alteració de la via de la senyalització de la insulina en el cervell, concretament de la via de la fosfatidilinositol-3-kinasa/protein-kinasa B (PI3K/Akt).
Un dels elements clau del metabolisme glucídic és garantir una aportació continuada de glucosa als teixits neuronals. Històricament s’interpretà aquesta preferència en el sentit que el cervell seria independent de l’acció de la insulina. No obstant, en els darrers anys s’ha comprovat en l’hipocamp, el cerebel o el bulb olfactori que la via de senyalització de la insulina a través de la PI3K/Akt té un paper important en la regulació del metabolisme de la glucosa en neurones.
El rol de la desregulació energètica en el trastorn bipolar es manifesta en símptomes com els desplaçaments en el ritme circadià i en el cicle d’activitat i de repòs. A principi dels anys 2000s s’hi constava, a més, a nivell neuronal una disfunció mitocondrial amb la disrupció associada de la producció energètica. Associada al trastorn bipolar apareix sovint una disfunció metabòlica caracteritzada per resistència a la insulina i un metabolisme anormal de la glucosa. Aquesta intersecció és especialment preocupant si atenem als canvis en l’alimentació i en els patrons d’activitat física experimentats per la població humana en les darreres dècades: al consegüent càrrega al·lostàtica sobre la fisiologia humana es manifesta en una epidèmia global de síndrome metabòlica.
En els teixits perifèrics, la síndrome metabòlica es manifesta en un augment de la prevalença de la diabetis de tipus 2. Campbell et al. alerten que la síndrome metabòlica i la resistència insulina també constituiria una estressor crònic sobre el cervell. Com ja s’ha dit, no és del tot cert que la insulina jugui un paper irrellevant en el cervell. Des de principi del segle XXI s’han reportat en neurones la presència de receptors de la insulina i dels mecanismes de senyalització subjacents. Neurones del sistema nerviós central són susceptibles, doncs, a la resistència a la insulina. La insulina hi regula la captació de glucosa i la generació d’ATP a través de la fosforilació oxidativa mitocondrial. Ratolins modificats genèticament perquè no expressin el receptor d’insulina en l’hipocamp manifesten comportaments de depressió i d’ansietat, amb dificultats cognitives i anormalitats metabòliques.
A banda de les neurones, la senyalització de la insulina també seria important en la regulació del metabolisme de la glucosa en les cèl·lules de suport del sistema nerviós, la glia. Els astròcits, per exemple, expressen la isoforma B dels receptors d’insulina. Així doncs, en cultius cel·lulars d’astròcits s’ha mostrat com la fructosa pot induir resistència a la insulina amb una disminució de l’expressió de receptors i de la fosforilació de l’Akt. Ratolins modificats genèticament perquè els seus astròcits no expressin receptors d’insulina tenen uns nivells més baixos d’alliberament de dopamina i manifesten ansietat i depressió.
L’acció del liti
Els estudis sobre l’acció del liti han posat de manifest múltiples efectes, però Campbell et al. assenyalen especialment l’efecte inhibidor sobre la GSK3 i el cicle de fosfatidilinositol (PI-cicle). Tant la GSK3 com el PI-cicle són components de la via de senyalització de la insulina a través de la PI3K/Akt. Si el PI-cicle és fonamental en el metabolisme de l’inositol i en el segons missatgers que se’n deriven, la GSK3 és influïda per l’Akt. La GSK3 és constitutivament activa de manera que la senyalització de la insulina hi actua a través d’una fosforilació transitòria d’efecte inactivador. La supressió temporal de l’activitat GSK3 afavoreix la importació de glucosa cap a l’interior de la cèl·lula, la seva metabolització a piruvat (glucòlisi) i la fosforilació oxidativa d’aquest en l’interior dels mitocondris amb generació d’ATP.
La insulina és una hormona peptídica que actua sobre les cèl·lules que expressen en les seves membranes receptors d’insulina (IR). La interacció dels IR amb el seu substrat produeix complexos (IRS) que activen adaptadors a la cara interna de la membrana que fosforilen residus de tirosina de diverses proteïnes. Aquesta cascada de fosforilacions arriba a la PI3K, activant-la. La PI3K fosforila el metabòlit fosfatidil-inositol 4,5-bisfosfonat (PIP2) convertint-lo en fosfatidilinositol 3,4,5-trifosfat (PIP3). És el PIP3 qui activa la Akt. Entre altres efectes, l’Akt fosforila els residus Ser21 de la GSK3α i Ser9 de la GSK3β: això inactiva transitòriament la subunitat β de la GSK3. Com ja s’ha dit aquesta inactivació transitòria és suficient per estimular el metabolisme energètic de la cèl·lula (captació de glucosa, respiració mitocondrial i producció d’ATP).
La resistència a la insulina és deguda en darrer terme a una sobreactivació crònica d’aquesta via de senyalització. Per exemple, la hiperinsulinèmia crònica acaba per saturar receptors i transductors de manera que, de retruc, la GSK3 queda en una estat de sobreactivitat permanent. Entre els efectes de la resistència cel·lular a la insulina hi ha una reducció del transport de glucosa mediat pel transportador GLUT 4, una inhibició del complex de la piruvat-deshidrogenasa i de la maquinària mitocondrial de la fosforilació oxidativa.
Ja en els anys 1980, hom havia observat que el liti era capaç de restaurar la sensibilitat a la insulina en models animals de resistència a la insulina. En el múscul s’ha observat que el liti pot duplicar amb escreix la captació de glucosa mediada per la insulina.
Pel que fa a la GSK3β, se sap que inhibidors específics d’aquest enzim milloren la sensibilitat a la insulina en models animals d’insulinoresistència.
A banda de l’efecte sobre els components de la via de PI3K/Akt, el liti també inhibeix directament la GSK3 en desplaçar el magnesi del seu lloc d’unió a l’enzim.
L’acció del liti sobre el cicle de PI alenteix el recanvi del PIP2. Aquest efecte sobre el PIP2 contrarestaria l’elevació crònica d’aquest metabòlit en pacients de trastorn bipolar en fase de mania. En pacients de trastorn bipolar eutímics, els nivells de PIP2 són inferiors als normals. La fluoxetina, fàrmac utilitzat contra la pressió, estimula el recanvi de PIP2.
Un dels productes del metabolisme del PIP3 és el diacilglicerol (DAG). El DAG té un efecte inhibidor sobre la via de senyalització de la insulina que s’interpreta com a retroalimentació negativa. El DAG actua sobre la protein-kinasa C (PKC), que és un dels mediadors de la via PI3K/Akt. El liti té un efecte inhibidor sobre l’activitat PKC.
En el metabolisme del DAG hi ha participa la diacilglicerol-kinasa (DGK) que el reincorpora al cicle de PI. És significatiu que estudis d’associació genòmica hagin identificat variants del gen DGHK com a factor de risc de desenvolupar trastorn bipolar.
Una altra via d’actuació del liti són els transportadors de sodi-mioinositol (SMIT). Els SMIT tenen el paper de fornir inositol a l’interior de la cèl·lula. En alguns pacients de trastorn bipolar de tipus 1 s’ha detectat una sobreexpressió de l’ARN del SMIT.
A la recerca de biomarcadors del sistema nerviós central
La detecció en sang perifèrica de vesícules extracel·lulars d’origen neuronal s’ha considerat en l’estudi de malalties neurodegeneratives. Això s’ha aplicat en l’estudi de la via de senyalització neuronal PI3K/Akt/GSK3β en la malaltia d’Alzheimer. La rellevància de la via en aquest procés de neurodegeneració va conduir a investigacions sobre l’efectivitat de la administració intranasal d’insulina. L’acoblament entre l’administració intranasal d’insulina i la imatge de ressonància magnètica del cervell s’ha assajat per detectar resistència a la insulina en diverses regions cerebrals.
Recentment, s’ha començat a estudiar les vesícules d’origen neuronal en sang perifèrica de pacients amb trastorns bipolar. Campbell et al. proposen estudiar-hi biomarcadors relacionats amb la funció mitocondrial i el metabolisme de la glucosa, com ara els nivells vesiculars de lactat, piruvat i components del cicle de Krebs. També s’hi podrien estudiar biomarcadors relacionats amb la senyalització de la insulina com els IRS, el PI3K, l’Akt, el GSK3β o el mTOR.
Val a dir que assaigs clínics com TRIO-BD, desenvolupat entre el 2015 i el 2021 ja han demostrat que l’administració de metformina (un sensibilitzador a la insulina) durant 26 setmanes millora els símptomes depressius de persones amb trastorn bipolar.
Lligams:
- Insulin signaling as a therapeutic mechanism of lithium in bipolar disorder. Iain H. Campbell, Harry Campbell, Daniel J. Smith. Translational Psychiatry 12: 350 (2022).
Cap comentari:
Publica un comentari a l'entrada