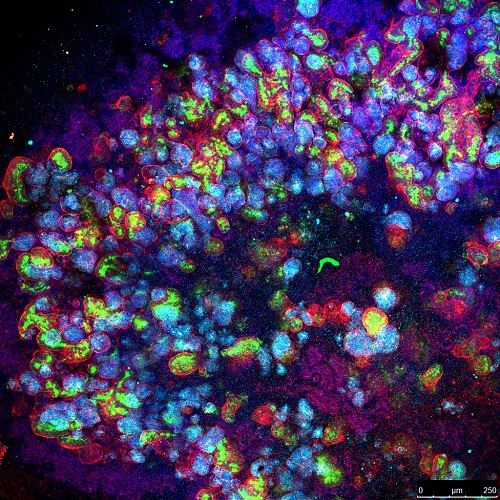
Electroscopia òptica confocal d’un organoid renal humà. La tinció de fluorescència evidencia les cèl·lules epitelials tubulars (verd), la laminina (vermell) i els nuclis cel·lulars (blau)
El rol d’ACE2 en la infecció per SARS-CoV-2
En aquesta recerca han intervingut membres del grup de Mirazimi de la Unitat de Microbiologia Clínica de l’Hospital Universitari Karolinska d’Estocolm (Vanessa Monteil) i de l’Institut Nacional de Veterinària d’Uppsala (Hyeso Kwon). Del grup de Montserrat de l’IBEC de Barcelona han participat Patricia Prado, Carmen Hurtado del Pozo i Elena Garreta. Del grup de Penninger de l’IMB de Viena han participat Astrid Hagelkrüys, Reiner A. Wimmer i Alexandra Leopoldi. A través de Montserrat, també han col·laborat membres del Programa de Terapia Celular de la Universidad de Navarra (Felipe Prosper i J. P. Romero). A través de Penninger, també han contribuït des de Vancouver Martin Stahl i Ryan Conder (de STEMCELL Technologies), així com Haibo Zhang i Arthur S. Slutsky (del Keenan Research Centre for Biomedical Science); i des de la mateixa Viena ho ha fet Gerald Wirnsberger (Apeiron Biologics).
Tots els experiments amb SARS-CoV-2 foren realitzats per Monteil, començant per l’aïllament. El projecte fou dissenyat per Penninger, Montserrat i Mirazimi. Kwon realitzà totes les qRT-PCR de SARS-CoV-2. Els organoids de vasos sanguinis foren desenvolupats per Hagelkrüys i Wimmer. Els organoids renals foren generats per Garreta, Prado i Hurtado, que també forniren les cèl·lules tubulars, i realitzaren anàlisis com qPCR, immunofluorescència, seqüenciació d’ARN. Prosper i Romero realitzaren l’anàlisi monocel·lular d’ARN. Wirnsberger aportà la hrsACE2 que ha desenvolupat a Apeiron Biologics. Penninger és fundador i accionista d’Apeiron Biologics, companyia que ha sol·licitat una patent per a l’ús d’hrsACE2 en la COVID-19 i per a l’ús d’organoids com a model preclínic d’assaigs contra la COVID-19.
El grup de Penninger forní ara fa 15 anys les proves genètiques que l’enzim 2 de la conversió de l’angiotensina (ACE2) és el receptor crític del coronavirus del SARS (SARS-CoV). La interacció del virus amb l’ACE2, a més, té un efecte patològic directe, ja que l’ACE2 contribueix en condicions fisiològics a la protecció del pulmó.
El virus responsable del brot pneumònic de Wuhan ha estat classificat en la mateixa espècie que el SARS-CoV, i així va rebre la denominació de SARS-CoV-2 (encara que alguns utilitzen preferentment la designació HCoV-19). En la infecció per SARS-CoV-2 el receptor clau és també ACE2, i per això una de les estratègies terapèutiques proposades contra el covid-19 és inhibir aquesta interacció.
En aquesta recerca Monteil et al. mostren que una forma recombinant humana de qualitat clínica d’ACE2 (hrsACE2) té la capacitat de reduir la proliferació del SARS-CoV-2 en un factor de 1000-5000 en un cultiu de cèl·lules Vero. Aquest és un efecte específic de l’ACE2 humana, ja que una forma recombinant murina (mrsACE2) no hi té cap efecte.
Valorar els resultats d’infeccions en cultius en monocapa és fa difícil ja que en aquestes condicions el comportament del virus no és del tot anàleg a la situació clínica. És aquí on entra l’experimentació preclínica en organoids. Monteil et al. han assajat la infecció per SARS-CoV-2 en organoids de vasos sanguinis humans, i troben que hrsACE2 la inhibeix. També es produeix una inhibició en organoids de ronyons humans.
Lligams:
- Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Vanessa Monteil, Hyesoo Kwon, Patricia Prado, Astrid Hagelkrüys, Reiner A. Wimmer, Martin Stahl, Alexandra Leopoldi, Elena Garreta, Carmen Hurtado del Pozo, Felipe Prosper, J.P. Romero, Gerald Wirnsberger, Haibo Zhang, Arthur S. Slutsky, Ryan Conder, Nuria Montserrat, Ali Mirazimi, Josef M. Penninger. Cell (2020).
- APEIRON Biologics, la companyia que ha desenvolupat l’hrsACE2
Cap comentari:
Publica un comentari a l'entrada